Натуральная древесина — древнейший строительный материал, который имеет природное происхождение, экологически чистый и долговечный. Но несмотря на прочность, дерево нередко портят насекомые, плесневые грибки, различные микробы. Без защиты материал может потемнеть и начать гнить.
- Зачем покрывать древесину медным купоросом
- Виды обработки древесины купоросом
- Поверхностное нанесение
- Обработка выдерживанием в растворе
- Внутреннее пропитывание
- Промышленная обработка
- Меры предосторожности
- Применение в садоводстве
- Использование купороса в качестве удобрения
Обработка древесины медным купоросом — надежный способ улучшения эксплуатационных характеристик свежесрубленного дерева, пиломатериала или готовых строений.
Зачем покрывать древесину медным купоросом
Древесные волокна напоминают губку: они могут впитывать большое количество влаги из воздуха или при непосредственном контакте с жидкостью. В спиленном дереве сохраняется сок, и при плохом просушивании оно может загнивать.
Дешевое средство от плесени на стенах. Медный купорос и белизна. Народный и бюджетный метод.

Без дополнительной обработки пиломатериал способен испортиться в короткий срок, при этом обычные лаки и краски только закупоривают влагу внутри, не давая ей испаряться. Намного эффективнее нанесение на древесину медного купороса — известного антисептического средства.
Сульфат меди, или медный купорос — соль серной кислоты, синеватый порошок, не имеющий запаха. Для человека и теплокровных животных токсичность этого вещества умеренная, зато для бактерий и многих насекомых он является высокотоксичным. Средство обладает такими свойствами:
- вяжущими;
- антисептическими;
- дезинфицирующими.
Если произвести обработку дерева купоросом, он начнет бороться с уже имеющимися проблемами и станет отличной мерой профилактики против древоточцев, плесневых микробов, бактерий, грибков. Вещество не меняет натурального оттенка дерева, зато останавливает развивающееся гниение. Из-за относительной безвредности, негорючести, нелетучести купорос можно применять в домах и загонах для скота.
Также к достоинствам средства относится его дешевизна и доступность в магазинах — оно продается повсеместно. Минус у вещества тоже имеется: портит металл, поэтому не годится для древесины, в которую уже вбиты гвозди, вкручены шурупы или имеются иные металлические элементы.
Виды обработки древесины купоросом
Медный купорос можно применять по-разному, каждый метод имеет свои особенности и отличия в проведении.
Поверхностное нанесение
Данный способ является наименее трудоемким, осуществить его можно быстро, но срок защиты поверхностей будет небольшим. Обычно нанесение сульфата меди данным методом практикуется при уже имеющейся гнили, грибковом поражении материала. Если древесина свежая или плохо просушена, вещество станет вымываться из основания еще быстрее.
Порядок работы таков:
- взять 10 г просеянного через мелкое сито купороса, развести в литре воды;
- смочить в растворе кисть или губку, ветошь;
- нанести разведенное средство на основание;
- для работы также можно применять распылитель: в него вливают раствор и орошают деревянную поверхность.

При такой обработке защищенным оказывается лишь слой древесины не более 2 мм толщиной. Если в материале появятся глубокие трещины, в них смогут поселиться грибки или насекомые.
Обработка выдерживанием в растворе
Обычно таким образом защищают деревянные столбы, которые далее предстоит закапывать в землю. Для досок, используемых на стройке, метод неудобен, так как расход медного купороса будет большим, а найти удобную тару не всегда удается. Готовят 20%-й раствор, погружают в него столбики (полностью или только в той части, которая будет в земле), оставляют на 2 суток. Затем сушат столбы естественным способом около месяца под навесом, расположив обработанным концом вниз.
Внутреннее пропитывание
Для обработки недавно спиленного дерева можно применять иной метод. Медный купорос при его выполнении смешается с еще не вышедшим древесным соком, что позволит ему проникнуть в более глубокие слои материала. Поскольку сокодвижение продолжается несколько дней, провести пропитку следует как можно раньше.

Процесс надо осуществлять так:
- положить дерево на землю;
- сделать поперечный надрез (пополам, но не до конца);
- в появившуюся щель вставить клин, чтобы увеличить расстояние между половинками дерева;
- установить туда свинцовую трубку, которая вторым концом уходит в емкость с 15–20%-м раствором сульфата меди (тара должна стоять на возвышенности);
- если есть возможность, замазать щель смолой или паклей, чтобы антисептик не вытекал на землю;
- оставить приспособление на 3–5 дней, затем просушить дерево.
Промышленная обработка
В промышленности используются специальные методы, подразумевающие применение профессионального оборудования. Дерево сушат, загружают в большой автоклав, заливают раствором купороса. При температуре около +40 градусов повышают давление до 10 атмосфер, в результате чего вещество проникает в глубокие слои материала. После получасовой обработки древесину достают и просушивают. В домашних условиях использование такой методики практически невозможно.
Меры предосторожности
Несмотря на малую опасность, медный купорос является химическим веществом, и при прямом контакте с кожей, слизистыми, попадании внутрь может нанести вред человеку. После действий с ним нужно прополоскать рот, вымыть лицо и руки. Работать со средством надо в перчатках, защитной одежде. Если нанесение раствора осуществляется в закрытом помещении, необходимо воспользоваться респиратором.

При проникновении состава внутрь организма появляются признаки отравления:
- тошнота, рвота;
- кожный зуд, проявления аллергии;
- рези в ЖКТ;
- слабость;
- аритмия.
При развитии этих симптомов следует обратиться за врачебной помощью без промедления!
Применение в садоводстве
Медный купорос знаком каждому садоводу — это недорогой и эффективный антисептик, уничтожающий вредителей. Обычно осуществляется опрыскивание деревьев ранней весной, когда почки только начинают набухать, а также осенью, когда листья уже опали. Летом орошение деревьев раствором делают редко, ведь он может сжечь зелень. На литр воды берут 20–30 г химического вещества.

Другие способы обработки деревьев:
- Для уничтожения вредителей в стволах. Взять 10 л воды, развести в ней 400 г извести, 300 г сульфата меди. Опрыскать стволы или нанести на них раствор кистью.
- Для лечения загнившего дерева или избавления от мха, лишайника. Развести 100 г купороса в литре воды, оросить пораженные зоны.
- Для лечения пятнистого некроза, болезней винограда. Приготовить 5%-й раствор купороса, опрыскать растения (желательно произвести работы осенью).

Использование купороса в качестве удобрения
В данном химическом веществе содержится медь, которая является ценным для растений микроэлементом. Ее нехватка проявляется пожелтением листьев, потерей яркости цветками, опаданием молодых побегов. Необходимо растворить 5–10 г купороса в ведре воды, после применять средство для внекорневой подкормки помидоров, капусты, картошки.
Медный купорос — дешевое, но очень полезное удобрение, качественный антисептик. Его можно применять без опаски, но с соблюдением технологии, пропорций и мер защиты — тогда результат будет отличным.
Источник: kraska.guru
Медный купорос

Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2- по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Свойства
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3H2O (этот процесс, то есть выветривание частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · H2O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650°С:
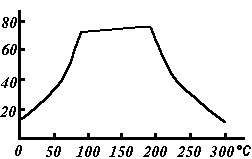
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5·10 -3 .
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Окрашивает огонь в зелёный цвет.

Применение
Сульфат меди(II) наиболее важная соль меди, часто служит исходным сырьём для получения других соединений.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком — от грибковых заболеваний и виноградной тли.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а так же для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519 (консервант).
В природе изредка встречается минерал Халькантит, состав которого близок к CuSO4*5H2O
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Медный купорос» в других словарях:
МЕДНЫЙ КУПОРОС — (сульфат меди), CuSO4?5H2O, лазурно синие кристаллы, tпл 95,88шC. Встречается в природе в виде минерала. Медный купорос применяют как протраву при крашении, для консервирования древесины, как пестицид, антисептик и вяжущее лекарственное средство … Современная энциклопедия
МЕДНЫЙ КУПОРОС — CuSO4.5H2O, см. Меди сульфат … Большой Энциклопедический словарь
МЕДНЫЙ КУПОРОС — м л, син. халькантита. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
медный купорос — CuSO4·5H2О, см. Меди сульфат. * * * МЕДНЫЙ КУПОРОС МЕДНЫЙ КУПОРОС, CuSO4·5H2O, см. Меди сульфат (см. МЕДИ СУЛЬФАТ) … Энциклопедический словарь
медный купорос — vario(II) sulfatas pentahidratas statusas T sritis chemija formulė CuSO₄·5H₂O atitikmenys: angl. copper(II) sulfate pentahydrate rus. меди(II) сульфата пентагидрат; медный купорос ryšiai: sinonimas – vario tetraoksosulfatas pentahidratas… … Chemijos terminų aiškinamasis žodynas
Медный купорос — (синий) (техн.), или серно медная соль CuSO4.5H2O встречается в природе, как вторичное образование, в виде кристаллов и натечных масс, или в виде раствора, в так называемых цементных водах. М. купорос известен был уже в древности, и Плиний, напр … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
медный купорос — синий купорос … Cловарь химических синонимов I
Медный купорос — кристаллогидрат Меди сульфата состава CuSO4 ․5H2O … Большая советская энциклопедия
МЕДНЫЙ КУПОРОС — сернокислая медь в кристаллах синего цвета. В чистом виде применяется только для опрыскивания деревьев в безлиственном состоянии (1 % раствор М. к., т. е. 1 кг М. к. на 100 л воды), чаще же в смеси с известковым молоком (см. Бордосская жидкость)… … Сельскохозяйственный словарь-справочник
МЕДНЫЙ КУПОРОС — см. Меди сульфат. МЕДЬ хим. элемент, символ Си (лат. Cuprum), ат. н. 29, ат. м. 63,546. М. розово красный металл; плотн.
8920 кг/м3. tпл 1084,5 °С. В природе изредка встречается в виде самородной М. и в виде соединений с серой (сульфидов) или… … Большой энциклопедический политехнический словарь
Источник: dic.academic.ru
Медный купорос ГОСТ 19347-99

Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
- 1 Нахождение в природе
- 2 Получение
- 2.1 В промышленности
- 2.2 В лабораторных условиях
- 2.3 Очистка
- 2.3.1 Глубокая очистка
- 3.1 Строение кристаллогидрата
- 3.2 Термическое воздействие
- 3.3 Растворимость
- 4.1 Электролитическая диссоциация
- 4.2 Реакция замещения
- 4.3 Реакция с растворимыми основаниями (щелочами)
- 4.4 Сокращённое ионное уравнение (Правило Бертолле)
- 4.5 Реакция обмена с другими солями
- 4.6 Прочее
Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.

В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты.
Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей.
Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
Пентагидрат сульфата меди (II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание.
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
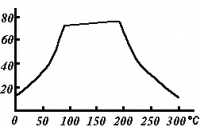
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
Растворимость
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди (II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Источник: chem.ru


