В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
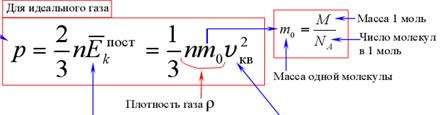
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
Урок 139. Основные положения МКТ.
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Источник: people-ask.ru
Физика. МКТ: Основные положения МКТ и их опытное обоснование. Центр онлайн-обучения «Фоксфорд»
МКТ– молекулярно-кинетическая теория
Цель МКТ – это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела – большие тела, состоящие из огромного числа молекул.
Тепловые явления – явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ:
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— открыто английским ботаником Р. Броуном в 1827 г.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено франц. физиком Ж. Перреном.
Размеры частиц:диаметр любого атома составляет около см.
Число молекул в веществе:
где V – объем вещества,
Vo – объем одной молекулы
Масса одной молекулы:
где m – масса вещества,
N – число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества:
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода
–величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса химического элемента:
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода
–величина безразмерная, т.е. не имеет единиц измерения
Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
(относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества:
Количество вещества (ν) определяет относительное число молекул в теле.
где N – число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль – это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества
где – масса молекулы, — постоянная Авогадро
Единица измерения молярной массы: [M]=1 кг/моль.
Масса любого количества вещества:
Количество вещества:
Число молекул в веществе:
Молярная масса:
Масса одной молекулы:
Связь между относительной молекулярной массой и молярной массой:
Концентрации молекул:
где N — число молекул газа
V — объем газа
Плотности газа:
где mo — масса молекулы
n — концентрация молекул (1/м 3 )
Температура

Температура — это мера средней кинетической энергии молекул, характеризует степень нагретости тел.
Прибор для измерения температуры — термометр.
Абсолютная шкала температур
— введена англ. физиком У. Кельвином
— нет отрицательных температур
Единица абсолютной температуры в СИ: [T] = 1K (Кельвин)
Нулевая температура абсолютной шкалы – это абсолютный ноль ( 0К = -273 С ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура — 0,0001К.
По величине 1К равен 1 градусу по шкале Цельсия.
Связь абсолютной шкалы со шкалой Цельсия:в формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».

Основное уравнение МКТ газа
Основное уравнение МКТ связывает микропараметры частиц ( массу молекулы, среднюю кинетическую энергию молекул, средний квадрат скорости молекул) с макропараметрами газа (р — давление, V — объем, Т — температура).
средняя кинетическая энергия поступательного движения молекул средняя квадратичная скорость
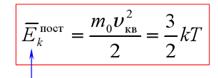
средняя кинетическая энергия поступательного движения молекул
Средняя квадратичная скорость: =
Внутренняя энергия одноатомного идеального газа: U = = pV


Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Источник: cyberpedia.su