— проводить расчет ЭДС окислительно-восстановительной реакции на основе понятия окислительно-восстановительного потенциала.
При определении степени окисления условно предполагают, что в соединении валентные электроны полностью переходят к более электроотрицательным атомам. В действительности же при образовании ковалентных связей происходит только смещение электронной пары от одного атома к другому. Таким образом, степень окисления – это условный заряд, который принял бы атом, если бы отдал или принял соответствующее число электронов.
При определении степени окисления элементов в соединении надо помнить, что в целом молекула электронейтральна, поэтому сумма положительных и отрицательных зарядов должна равняться нулю.
Пример K + Mn +7 O -2 4
Основные положения теории окислительно-восстановительных реакций:
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом:
Na 0 – 1e ® Na + . При окислении степень окисления повышается.
ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по Химии
Атомы, молекулы или ионы, отдающие электроны, называются восстановителями, в реакции они окисляются.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом: Cl2 0 + 2e ® 2Cl — . При восстановлении степень окисления понижается.
Атомы, молекулы или ионы, принимающие электроны, называются окислителями, в реакции они восстанавливаются.
3. Процессы окисления и восстановления протекают одновременно. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
4. Окислительно-восстановительная способность атома в соединении связана с его электронной структурой.
Например, рассмотрим окислительно-восстановительные свойства соединений серы в зависимости от строения валентных электронов центрального атома: H2S -2 , H2S +4 O3 , H2S +6 O4
В нормальном состоянии атома, чему соответствует нулевая степень окисления, атом серы имеет шестиэлектронную структуру:
| S 0 |
3 s
В Н2S сера имеет отрицательную степень окисления -2, чему соответствует восьмиэлектронная оболочка валентного слоя:
| S -2 |
3s
Больше принять электронов она не может, а может только отдавать, следовательно, сероводород – восстановитель.
В H2SO3 сера находится в промежуточной степени окисления +4, это соответствует следующей электронной конфигурации:
| S +4 |
3s
В данном случае сернистая кислота может быть как окислителем (принять электроны на свободные орбитали) так и восстановителем (отдать электроны).
В третьем соединении сера имеет положительную максимальную степень окисления +6 (валентных электронов нет, орбитали свободны), т.е. частица может принимать электроны.
| S +6 |
3s
ОВР Шоу: Квартира в новостройке (ДО/ПОСЛЕ)
Следовательно, серная кислота – окислитель.
Таким образом, окислительно-восстановительные свойства легко определяются исходя из степени окисления атома в соединении (табл. 11).
Источник: studopedia.ru
Окислительно-восстановительные реакции (ОВР): примеры
Что такое ОВР? Примеры таких реакций можно обнаружить не только в неорганической, но и в органической химии. В статье мы дадим определения основным терминам, используемым при разборе подобных взаимодействий. Кроме того, мы приведем некоторые ОВР, примеры и решения химических уравнений, которые помогут понять алгоритм действий.

Основные определения
Но вначале давайте вспомним основные определения, которые помогут разобраться в процессе:
- Окислителем называют атом либо ион, способный в процессе взаимодействия принимать электроны. В виде серьезных окислителей выступают минеральные кислоты, перманганат калия.
- Восстановитель — это ион либо атом, который отдает валентные электроны другим элементам.
- Процесс присоединения свободных электронов называют окислением, а отдачи – восстановлением.
Алгоритм действий
Как разобрать уравнения ОВР? Примеры, предлагаемые выпускникам школ, предполагают расстановку коэффициентов путем электронного баланса. Приведем порядок действий:
- Сначала необходимо поставить у всех элементов значения степеней окисления в простых и сложных веществах, участвующих в предложенном химическом превращении.
- Далее выбираются те элементы, которые поменяли цифровое значение.
- Знаками «+» и «-» указывают принятые и отданные электроны, их количество.
- Далее между ними определяют наименьшее общее кратное, определяют коэффициенты.
- Полученные цифры ставят в уравнение реакции.
Первый пример
Как выполнить задание, связанное с ОВР? Примеры, предлагаемые на выпускных экзаменах в 9 классе, не подразумевают добавления формул веществ. Ребятам, как правило, необходимо определить коэффициенты и вещества, поменявшие значения валентности.
Рассмотрим те ОВР (реакции), примеры которых предлагаются выпускникам 11-х классов. Школьники должны самостоятельно дополнить уравнение веществами и только после этого путем электронного баланса расставить коэффициенты:
Для начала расставим в каждом соединении степени окисления. Так, в пероксиде водорода у первого элемента она соответствует +1, у кислорода -1. В серной кислоте следующие показатели: +1, +6, -2 (в сумме получаем нуль). Кислород является простым веществом, поэтому у него нулевой показатель степени окисления.
В перманганате калия, а также в сульфате марганца (2) получаем следующие значения:
Расставив значения у элементов, предложенных в задании, необходимо закончить ОВР. Примеры таких взаимодействий аналогичны, поэтому при решении нужно выявить атомы (ионы), которые проявляют окислительные и восстановительные свойства.
Так, в качестве одного из недостающих продуктов реакции будет выступать соль калия, а именно сульфат. Вторым веществом является вода, так как процесс протекает с участием серной кислоты, обладающей гигроскопичными свойствами.
Следующим же этапом будет составление электронного баланса данного процесса:
- 2O – отдает 2 электрона =O 2 0 5 (восстановитель);
- Mn +7 принимает 5 электронов = Mn +2 2 (окислитель).
В процессе расстановки коэффициентов, обязательно суммируем атомы серы, получаем готовое уравнение процесса:

Сложные моменты
Какие сложности возникают у школьников при разборе ОВР? Примеры, предлагаемые в выпускных тестах по химии, ребята должны закончить самостоятельно, что и вызывает у них затруднения.
Необходимо дополнить недостающие вещества и расставить в уравнении необходимые стереохимические коэффициенты. В предложенном задании степень окисления меняет железо: с +2 на +3, следовательно, проявляет восстановительные свойства. Бихромат калия выступает в качестве окислителя, понижая значение степени окисления с +6 до +3.
В качестве недостающих продуктов реакции будут выступать вода, а также хлорид калия. Они не принимают участия в электронном балансе, так как у элементов, входящих в их состав, не наблюдается изменения их числового значения. Электронный баланс для данного процесса будет иметь следующий вид:
- Fe+2 отдает 1 электрон = Fe +3 6 (восстановитель);
- 2Cr+6 принимает 6 e = 2Cr +3 1 (окислитель).
При расстановке коэффициентов в данную схему, суммируем атомы хлора:
Еще один пример взаимодействия
Продолжим разговор о том, как правильно разобрать ОВР. Химия (примеры таких реакций в ней являются обычными) не только объясняет алгоритм действий, но и характеризует суть происходящих процессов. Рассмотрим еще один пример взаимодействия, сопровождающегося образованием новых химических веществ:
В данном примере есть два элемента, которые меняют степени окисления: йод и марганец. Выясним, какие вещества будут образовываться в качестве продуктов данной химической реакции.
Так как в процессе принимает участие серная кислота, одним из образующихся веществ будет вода. В правой части нет соединения у калия, поэтому вторым продуктом станет сульфат этого щелочного металла.
Электронный баланс для данного взаимодействия имеет следующий вид:
- Mn+7 принимает 5 e = Mn +2 2, является окислителем;
- 2I — отдает 2e = I2 0 5, выступает в качестве восстановителя.
На завершающем этапе данного задания расставим коэффициенты в готовой схеме и получим:
Заключение
Данные процессы нашли серьезное применение в химическом анализе. С их помощью можно открывать и разделять различные ионы, проводить метод оксидиметрии.
Разнообразные физические и химические методы анализа основываются на ОВР. Теория кислотного и основного взаимодействия поясняет кинетику протекающих процессов, позволяет проводить по уравнениям количественные вычисления.
Для того чтобы школьники, выбравшие химию для сдачи на выпускном экзамене, успешно прошли эти испытания, необходимо отработать алгоритм уравнивания ОВР на основе электронного баланса. Учителя отрабатывают со своими воспитанники методику расстановки коэффициентов, используя при этом разнообразные примеры из неорганической и органической химии.
Задания, связанные с определением степеней окисления у химических элементов в простых и сложных веществах, а также с составлением баланса между принятыми и отданными электронами, являются обязательным элементом экзаменационных тестов на основной, общей ступени обучения. Только в случае успешного выполнения таких заданий, можно вести речь о результативном освоении школьного курса неорганической химии, а также рассчитывать на получение высокой оценки на ОГЭ, ЕГЭ.
Источник: www.syl.ru
Окислительно-восстановительные реакции. Окислитель и восстановитель

Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
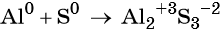
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:

Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
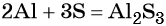
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
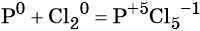
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
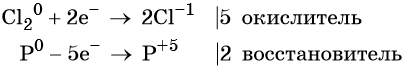
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
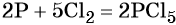
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
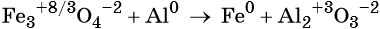
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
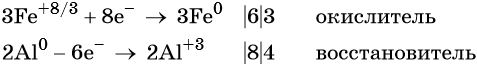
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
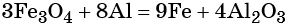
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
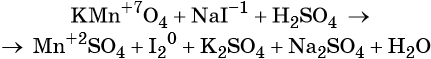
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I2 0 . Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
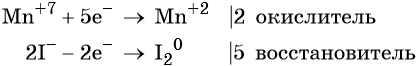
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
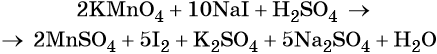
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
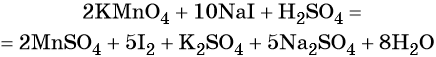
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
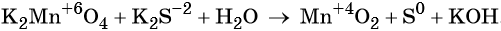
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S 0 . Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
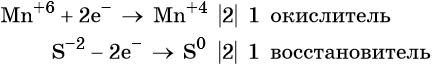
Основные коэффициенты в уравнении реакции равны единице:
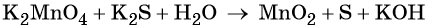
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
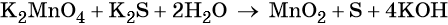
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
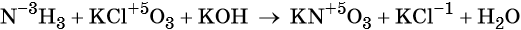
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:

Проставляем найденные основные коэффициенты в уравнение реакции:
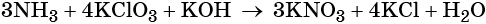
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
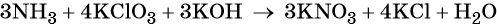
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
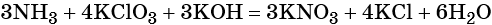
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
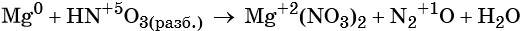
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
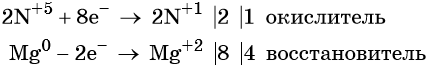
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
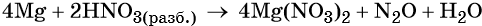
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
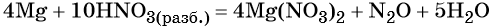
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
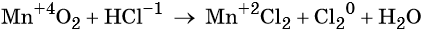
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl2 0 , хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
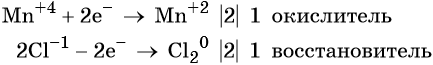
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
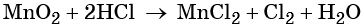
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
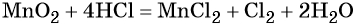
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
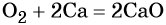
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
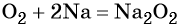
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
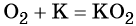
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
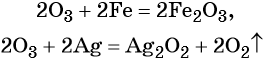
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
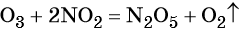
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn 2+ , в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO4 2– . Данные переходы описываются следующими уравнениями
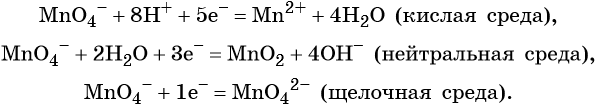
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
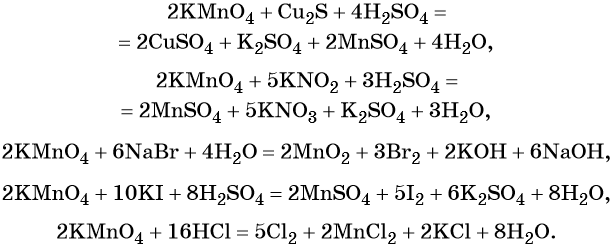
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
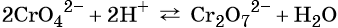
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
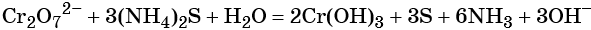
В кислой среде образуются ионы Cr 3+ :
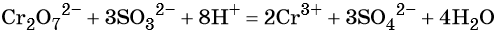
В щелочной — производные анионного комплекса [Cr(OH)6] 3– :
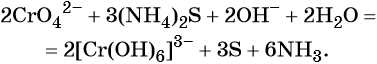
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
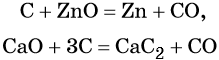
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:

Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
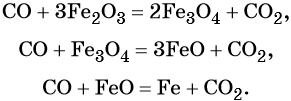
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
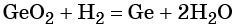
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
Источник: himi4ka.ru
Окислительно-восстановительные реакции. Классификация ОВР

Видеоурок формирует у учащихся представление об основных окислителях и восстановителях, процессах окисления и восстановления, классификации ОВР. Этот видеосюжет позволяет познакомиться с различными способами расстановки коэффициентов в окислительно-восстановительных реакциях (как органических, так и неорганических).
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности



Конспект урока «Окислительно-восстановительные реакции. Классификация ОВР»
К концу 18 века широкое распространение в химии получила кислородная теория окисления. Согласно этой теории окисление – это процесс соединения вещества с кислородом, а восстановление – это процесс отнятия у него кислорода. Согласно данной теории в химических реакциях, протекающих с изменением степеней окисления атомов, происходит передача электронов от одних частиц к другим. Такими частицами могут быть атомы, ионы.
Окислительно-восстановительные процессы лежат в основе многих явлений природы, в основе промышленных производств, без них невозможна жизнедеятельность человека, животных и растений.
Все химические реакции можно разделить на два типа. Это реакции, которые протекают без изменения степени окисления, то есть степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Так, в реакции серной кислоты с гидроксидом калия степени окисления элементов в исходных веществах равны степеням окисления этих элементов в продуктах реакции.
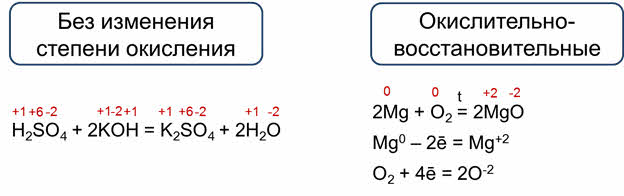
Так, в реакции магния с кислородом магний и кислород изменяют свои степени окисления: магний с нуля до плюс двух, а кислород с нуля до минус двух.
Изменение степеней окисления в ходе окислительно-восстановительных реакций обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам другого элемента. В данной реакции каждый атом магния отдаёт два электрона и эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле кислорода присоединяет два электрона, поэтому молекула кислорода присоединяет четыре электрона.
Окислительно-восстановительными являются реакции железа с хлором, потому что железо изменяет свою степень окисления с нуля до плюс трёх, а хлор – с нуля до минус единицы.
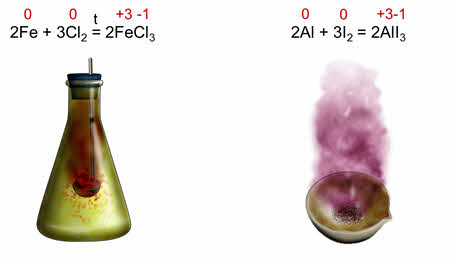
Окислительно-восстановительной является и реакция алюминия с йодом, здесь алюминий изменяет свою степень окисления с нуля до плюс трёх, а йод – с нуля до минус единицы.
Рассмотрим реакцию взаимодействия перманганата калия с соляной кислотой.
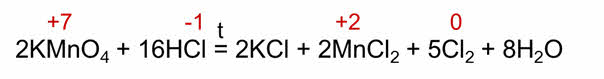
В этой реакции атомы хлора, которые в молекуле аш-хлор имеют степень окисления минус один, отдают по одному электрону и превращаются в нейтральные атомы хлора. А атом марганца, который в перманганате калия имеет степень окисления плюс семь, присоединяет пять электронов и превращается в атом марганца со степенью окисления плюс два.
Таким образом, любая окислительно-восстановительная реакция представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления степень окисления элемента повышается.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления степень окисления понижается.
Таким образом, атомы, молекулы или ионы, которые отдают электроны, называются восстановителями. Частицы, которые присоединяют электроны, называются окислителями.
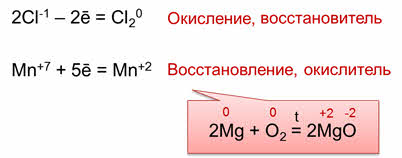
Поэтому, в рассмотренных реакциях восстановителями являются магний и соляная кислота, а окислителями – кислород и перманганат калия. Восстановитель участвует в процессе окисления, то есть окисляется, а окислитель участвует в процессе восстановления, то есть восстанавливается.
Какие же вещества могут быть окислителями, а какие восстановителями? Если в состав вещества входит элемент с высшей степенью окисления, то он может только понижать степень окисления, то есть участвовать в процессе восстановления и это вещество может быть только окислителем.
Только окислителем может быть: перманганат калия, так как марганец здесь в высшей степени окисления – плюс семь. Если в состав вещества входит элемент с низшей степенью окисления, то он может только повышать её, то есть участвовать в процессе окисления, и это вещество может выступать только в роли восстановителя.
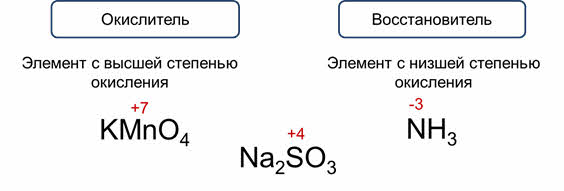
Так, в аммиаке степень окисления азота минус три, а это для него низшая степень окисления.
Если в состав вещества входит элемент с промежуточной степенью окисления, то он может повышать и понижать её, то есть может участвовать в процессах и окисления, и восстановления. Это вещество в данном случае может быть и окислителем, и восстановителем.
Так, в сульфите натрия степень окисления серы плюс четыре, а это промежуточная степень окисления. Будет сульфит натрия окислителем или восстановителем зависит от другого участника реакции.
Так, в реакции с перманганатом калия сульфит натрия является восстановителем, так как сера повышает свою степень окисления до плюс шести, а в реакции с сероводородом, сера понижает свою степень окисления и выступает в роли окислителя.
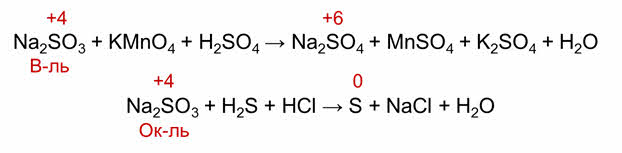
Следовательно, важнейшими окислителями являются простые вещества-неметаллы с наибольшими значениями электроотрицательности: фтор, кислород.
К важнейшим окислителям относятся также сложные вещества, которые содержат элементы в высшей степени окисления: перманганат калия, бихромат калия, азотная кислота и её соли, концентрированная серная кислота, оксид свинца четыре, хлорная кислота и её соли.
Окислительные свойства кислорода в пероксидах нашли своё применение при отбеливании тканей, бумаги. В присутствии перекисли водорода сульфид свинца два переходит в сульфат свинца два, эта реакция используется при реставрации картин.
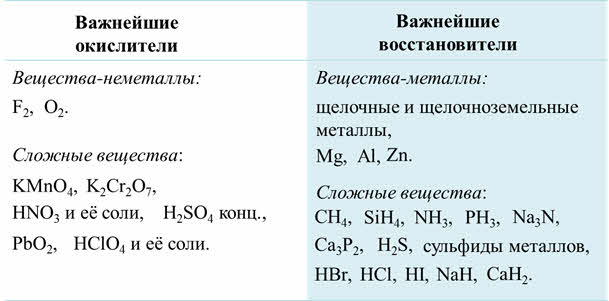
Важнейшими восстановителями являются простые вещества-металлы, например, щелочные и щелочноземельные металлы, магний, алюминий, цинк. К важнейшим восстановителям относятся также сложные вещества, которые содержат элементы в низшей степени окисления, как метан, силан, аммиак, фосфин, нитриды и фосфиды металлов, сероводород и сульфиды металлов, бромоводород, хлороводород, йодоводород и галогениды металлов, а также гидриды металлов.
Среди веществ, содержащих элементы в промежуточной степени окисления, есть вещества, для которых характерны или окислительные, или восстановительные свойства.
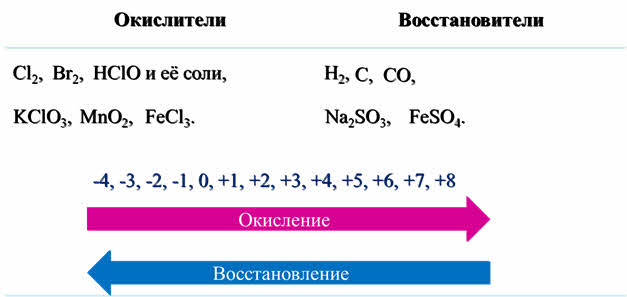
Так, окислителями обычно являются хлор, бром, хлорноватистая кислота и её соли, хлораты, оксид марганца четыре, соли трёхвалентного железа.
А в роли восстановителей чаще всего выступают водород, углерод, оксид углерода два, сульфиты металлов, соли двухвалентного железа.
Различают три типа окислительно-восстановительных реакций.
Это межмолекулярные окислительно-восстановительные реакции, в которых окислитель и восстановитель входит в состав различных веществ. Например, в реакции хлорида железа три с йодидом калия окислитель и восстановитель входит в состав различных веществ. Железо – окислитель входит в состав хлорида железа три, а йод – восстановитель, входит в состав йодида калия.
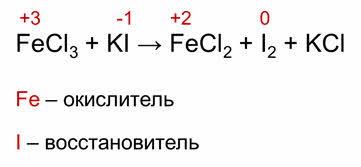
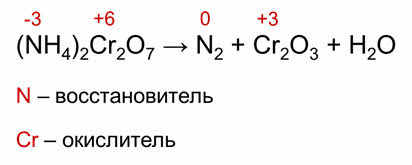
К внутримолекулярным окислительно-восстановительным реакциям относятся реакции, в которых окислитель и восстановитель входит в состав одного вещества. К этому типу реакций относится большинство реакций разложения. Так, в реакции разложения бихромата аммония элемент-окислитель и элемент-восстановитель находится в одном веществе. Так, азот является восстановителем в составе бихромата аммония, а хром является окислителем, также в составе бихромата аммония.
К реакциям самоокисления-самовосстановления, или диспропорционирования, относятся реакции, в которых один и тот же элемент и окисляется, и восстанавливается. Так, в реакции оксида азота пять с водой азот и повышает свою степень окисления до плюс пяти и понижает до плюс трёх, то есть он и окисляется, и восстанавливается.
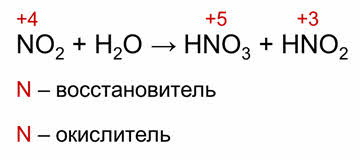
Для того чтобы составить уравнения окислительно-восстановительных реакций необходимо соблюдать следующую последовательность:
· Записать схему химической реакции;
· Расставить степени окисления атомов элементов; выделить элементы, которые изменили свои степени окисления, определить окислитель и восстановитель;
· Определить число отданных и принятых электронов, составить электронный баланс;
· Подобрать коэффициэнты в уравнении реакции.
Расставим коэффициенты в уравнении реакции сероводорода с кислородом. Сначала записываем схему химической реакции.
Расставляем степени окисления, выделяем элементы, которые изменили степени окисления, у нас – это сера и кислород.
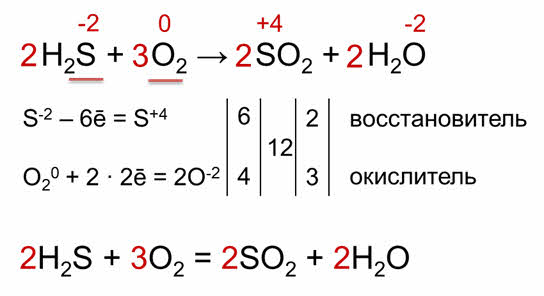
Затем определяем число электронов, приобретенных атомами кислорода и отданных атомами серы. Так сера отдает шесть электронов, а кислород принимает четыре электрона. Следовательно, сера – восстановитель, а кислород – окислитель.
Для того чтобы уравнять число отданных и принятых электронов, находим наименьшее кратное этих чисел, то есть это 12, 12 делим на 6 будет 2, 12 делим на 4 будет 3. Результаты деления и будут коэффициенты в уравнении реакции. Переносим эти коэффициэнты в левую часть схемы химической реакции, а число атомов водорода, которые не участвовали в окислительно-восстановительном процессе, уравниваем подбором. Теперь вместо стрелки можно поставить знак равенства между исходными веществами и продуктами реакции.
В реакциях металлов с некоторыми кислотами коэффициэнты расставляются иначе. Запишем схему химической реакции магния с разбавленной азотной кислотой.
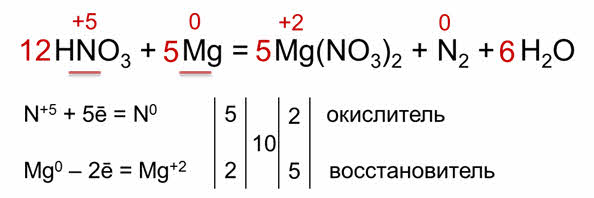
Расставляем степени окисления элементов, магний и азот изменили свои степени окисления. Определяем число отданных и присоединённых электронов. Так, азот присоединяет пять электронов, а магний отдаёт два электрона. Азот – окислитель, а магний – восстановитель.
Находим наименьшее общее кратно – десять. 10 делим на 5 будет 2, десять делим на 2 будет 5. Переносим полученные коэффициэнты в схему реакции. На связывание пяти моль ионов магния необходимо 10 моль нитрат-ионов, то есть дополнительно 10 моль азотной кислоты, кроме тех двух молей, которые пошли на окисление магния. Следовательно, в левой части уравнения перед формулой азотной кислоты нужно поставить коэффициэнт 12. Остаётся подсчитать число атомов кислорода до реакции, оно равно 36, значит перед формулой воды нужно поставить коэффициэнт шесть, потому что в нитрате магния 30 атомов кислорода.
В некоторых окислительно-восстановительных реакциях более двух элементов изменяют свои степени окисления. В реакции сульфида фосфора три с азотной кислотой фосфор, сера и азот изменяют свои степени окисления. Фосфор отдаёт 4 электрона, сера – 18, а азот принимает 1 электрон.
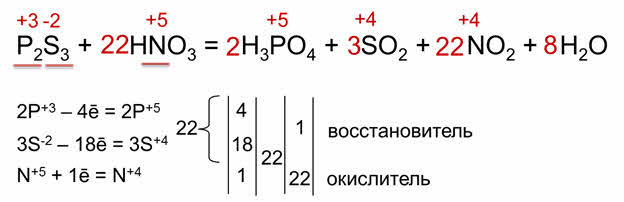
Таким образом, фосфор и сера являются восстановителями, а азот – окислителем. Следовательно, складываем число электронов, отданных восстановителями, получается 22 электрона. Для того чтобы сбалансировать число электронов, находим наименьшее общее кратное – 22. Делим 22 на 22 получаем 1, 22 делим на 1 получаем 22. Переносим полученные коэффициэнты в схему химической реакции.
Уравниваем число атомов фосфора и серы до и после реакции, в последнюю очередь считаем число атомов кислорода. До реакции 66 атомов кислорода, значит, перед формулой воды следует поставить коэффициент 8.
Изменяя пэ-аш среды можно изменить продукт реакции. Так, в кислой среде перманганат калия восстанавливается до марганца со степенью окисления плюс два, в нейтральной среде – до оксида марганца четыре (пауза), а в щелочной – до марганат-иона.
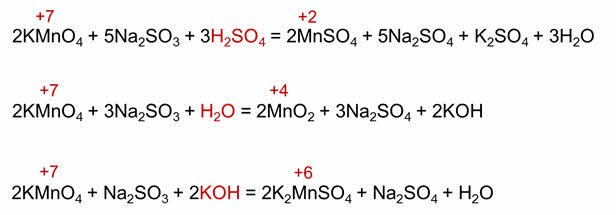
Для органических реакций коэффициэнты расставляются аналогично. Запишем схему реакции окисления этилена до этиленгликоля.
Определяем степени окисления атомов элементов, учитывая, что электроотрицательность атома углерода больше чем атома водорода, но меньше, чем кислорода. Так, в этилене степень окисления углерода минус два, а в этиленгликоле минус один, марганец также меняет свою степень окисления с плюс семи до плюс четырёх. Углерод отдаёт два электрона, а марганец принимает 3 электрона.
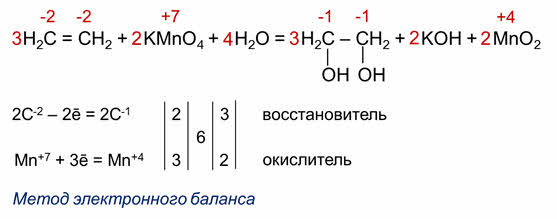
Следовательно, углерод – восстановитель, а марганец – окислитель. Находим наименьшее кратное – шесть. 6 делим на 2 будет 3, шесть делим на 3 будет 2. Полученные коэффициэнты переносим в схему реакции. Считаем атомы кислорода в продуктах реакции – 12. Следовательно, перед формулой воды следует поставить коэффициэнт 4.
Этот метод уравнивания окислительно-восстановительных реакций называется методом электронного баланса.
В органической химии кроме этого метода удобно использовать метод макроподстановки. Разберём этот метод на примере предыдущей реакции.
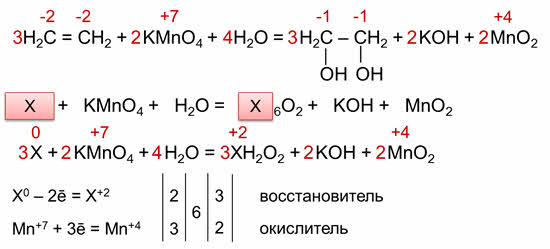
Выделим общий фрагмент в молекулярной формуле исходного органического вещества и продукта. В нашем случае это фрагмент цэ-два-аш-четыре, который мы обозначим за икс.
Перепишем исходную схему реакции в упрощённом виде, а затем расставляем степени окисления. Икс изменяет свою степень окисления и марганец. Икс отдаёт 2 электрона и повышает свою степень окисления до плюс двух, а марганец принимает 3 электрона и понижает степень окисления до плюс четырёх.
Находим также наименьшее общее кратное, которое делим на число отданных и принятых электронов и получаем соответствующие коэффициэнты, которые переносим в схему реакции.
В последнюю очередь уравниваем кислород. Полученные таким образом коэффициэнты можно перенести в исходное уравнение реакции.
Окислительно-восстановительные реакции являются самыми распространёнными в природе и на производстве. В природе – это дыхание и обмен веществ во всех живых организмах, фотосинтез, брожение, гниение. В промышленности их применяют при получении металлов, аммиака, кислот, при изготовлении фотографий. В повседневной жизни мы также встречаемся с окислительно-восстановительными процессами: ржавление железа, горение природного газа, потемнение серебряных изделий.
Источник: videouroki.net