1 ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия;
2 ГБУЗ города Москвы «Городская клиническая больница №31 ДЗМ», Москва, Россия;
3 ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль, Россия;
4 ООО «Атлас», Москва, Россия;
5 ГБУЗ города Москвы «Научно-исследовательский институт неотложной детской хирургии и травматологии ДЗМ», Москва, Россия
Цель обзора. Предоставить данные о современных возможностях диагностики и лечения пищевода Баррета. Пищевод Баррета — это патологическое состояние, развивающееся вследствие метапластической трансформации многослойного плоского неороговевающего эпителия слизистой оболочки дистальных отделов пищевода в цилиндрический эпителий кишечного типа.
Актуальность совершенствования методов своевременной диагностики и лечения пищевода Баррета, необходимость повышения эффективности наблюдения за такими пациентами обусловлены прежде всего ростом заболеваемости аденокарциномой пищевода в развитых странах и высокими показателями смертности от этой патологии. Факторами риска развития пищевода Баррета и последующей его злокачественной трансформации являются гастроэзофагеальная рефлюксная болезнь, ожирение, мужской пол, возраст старше 50 лет, курение, отягощенная по пищеводу Баррета и аденокарциноме пищевода наследственность. В последнее время значительный прогресс достигнут в разработке подходов к диагностике пищевода Баррета и ассоциированных с ним неопластических изменений, а также в эффективной эндоскопической терапии дисплазии, что в значительной степени снижает риск прогрессирования до аденокарциномы.
Радиочастотная абляция при пищеводе Баррета
Ключевые слова: аденокарцинома пищевода, пищевод Баррета, гастроэзофагеальная рефлюксная болезнь, узкоспектральная и увеличительная эндоскопия, эндоскопическая резекция.
КАК ЦИТИРОВАТЬ: Кайбышева В.О., Кашин С.В., Карасев А.В., Меркулова А.О., Крайнова Е.А., Федоров Е.Д., Шаповальянц С.Г. Пищевод Баррета: современное состояние проблемы. Доказательная гастроэнтерология. 2020;9(4):33–54. ht tps://doi.org/10.17116/dokgastro2020904133
Update on Barrett’s esophagus diagnosis and treatment
1 Pirogov Russian National Research Medical University, Moscow, Russia;
2 City Clinical Hospital No. 31 of the Moscow Healthcare Department, Moscow, Russia;
3 Yaroslavl Regional Clinical Oncology Hospital, Yaroslavl, Russia;
4 Atlas LLC, Moscow, Russia;
5 Research Institute of Emergency Pediatric Surgery and Traumatology of the Moscow Healthcare Department, Moscow, Russia
Aim. To present updated data on Barrett’s esophagus diagnosis and treatment. Barrett’s esophagus is a condition that develops as a result of the stratified squamous epithelium replacement in the distal esophagus by metaplastic columnar epithelium that has intestinal features. Rising incidence and mortality from esophageal adenocarcinoma in developed countries demand urgent development of Barrett’s esophagus’ diagnostic and treatment methods. Risk factors for the development of Barrett’s esophagus and esophageal adenocarcinoma are gastroesophageal reflux disease, obesity, male sex, age over 50 years, smoking, and family history.
Бартер. Схемы использования бартера
Recently, significant progress has been made in the development of the diagnosis of Barrett’s esophagus and esophageal adenocarcinoma and effective endoscopic treatment of dysplasia, which significantly reduces the risk of progression to adenocarcinoma.
Keywords: esophageal adenocarcinoma, Barrett’s esophagus, GERD, narrow-band imaging with magnifying endoscopy, endoscopic resection.
TO CITE THIS ARTICLE: Kaibysheva VO, Kashin SV, Karasev AV, Merkulova AO, Krainova EA, Fedorov ED, Shapovalyants SG. Update on Barrett’s esophagus diagnosis and treatment. Russian Journal of Evidence-based Gastroenterology = Dokazatel’naya gastroenterologiya. 2020;9(4):33–54. (In Russ.). ht tps://doi.org/10.17116/dokgastro2020904133
Пищевод Баррета (ПБ) — это патологическое состояние, развивающееся вследствие метапластической трансформации многослойного плоского неороговевающего эпителия слизистой оболочки дистальных отделов пищевода в цилиндрический эпителий кишечного типа [1]. Согласно современным рекомендациям Европейского общества гастроинтестинальной эндоскопии, для установления диагноза ПБ длина участка цилиндроклеточной метаплазии, расположенного проксимальнее зоны пищеводно-желудочного соединения, должна составлять не менее 1 см [2]. Ведущей причиной развития кишечной метаплазии признается хроническое воспаление слизистой оболочки пищевода, индуцированное рефлюксом агрессивного желудочного содержимого в пищевод [1]. Считается, что участки кишечной метаплазии в пищеводе обладают определенным злокачественным потенциалом и через ряд последовательных изменений, включающих дисплазию низкой и высокой степени, приводят к развитию аденокарциномы пищевода (АКП) [3, 4].
Актуальность вопроса своевременной диагностики и лечения ПБ обусловлена прежде всего колоссальным ростом (600% за последние 30—40 лет) заболеваемости АКП в развитых странах, что неизбежно сказывается и на структуре смертности от данного заболевания. Пятилетняя выживаемость при АКП на сегодняшний день не превышает 20% [5].
Перечисленные факты подчеркивают необходимость понимания факторов риска развития ПБ и АКП (наследственность, образ жизни, влияние микробиоты), важность своевременной диагностики, систематического наблюдения и адекватного лечения ПБ и ранних стадий АКП. Так, на сегодняшний день получены вполне обнадеживающие результаты хирургического или эндоскопического лечения АКП (5-летняя выживаемость более 80%) при выявлении опухоли на стадии T1 [6]. Кроме того, данные рандомизированных контролируемых исследований демонстрируют возможность существенного снижения риска развития АКП при своевременном проведении эндоскопической абляции участков ПБ с дисплазией [7, 8].
Диагностика
В норме слизистая оболочка пищевода выстлана многослойным плоским неороговевающим эпителием, который при проведении эндоскопического исследования выглядит бледно-розовым, «жемчужным». Участки метаплазии в пищеводе визуализируются в виде темно-розовых очагов («языки пламени») на фоне «жемчужно-белого» эпителия пищевода.
Установление диагноза «пищевод Баррета» требует соблюдения двух ключевых условий:
1) длина участка цилиндроклеточной метаплазии, расположенного проксимальнее зоны пищеводно-желудочного соединения (определяемой по проксимальному краю желудочных складок), должна составлять не менее 1 см;
2) гистологическое подтверждение признаков кишечного эпителия в биоптатах, полученных при проведении эзофагогастродуоденоскопии (ЭГДС) из видимых участков цилиндроклеточной метаплазии дистального отдела пищевода.
Следует отметить, что необходимость верификации кишечной метаплазии признается не всеми сообществами, так, например, в Великобритании и Японии установление диагноза ПБ признано правомочным при выявлении цилиндроклеточной метаплазии любого типа.
В России в соответствии с рекомендациями Российской гастроэнтерологической ассоциации для установления диагноза «пищевод Баррета» требуется обязательное гистологическое подтверждение метаплазии эпителия слизистой оболочки пищевода по кишечному типу [9].
Необходимость следования этим критериям обусловлена тем, что большинство имеющихся на сегодняшний день исследований показывают, что только кишечный тип цилиндрического эпителия отличается повышенным потенциалом малигнизации [10, 11]. То же самое касается сегмента метаплазии размером менее 1 см. Во-первых, согласно данным популяционных и мультицентровых когортных исследований, риск возникновения АКП при столь малых размерах возможного сегмента метаплазии крайне низкий [12, 13], а во-вторых, сложность установления границы пищеводно-желудочного соединения имеет невысокий уровень согласия между специалистами при определении неровной Z-линии и истинного сегмента цилиндроклеточной метаплазии в пищеводе длиной менее 1 см и может привести к гипердиагностике ПБ. Существуют работы, показывающие, что более 33% диагнозов «пищевод Баррета» снимаются при пересмотре опытным специалистом [14]. А между тем ошибочное установление такого диагноза ведет к психологической травме пациента, проведению повторных эндоскопических исследований, повышает нагрузку на систему здравоохранения.
В настоящее время во избежание разночтений при описании границ и протяженности сегмента цилиндроклеточной метаплазии дистального отдела пищевода во всем мире принято использовать так называемые Пражские критерии (The Barrett’s Prague C длина сегментов отмечена от зоны пищеводно-желудочного соединения (эндоскопическое заключение: пищевод Баррета C-3, M-5); б — детализированное эндоскопическое изображение сегментов цилиндроклеточной метаплазии в пищеводе, полученное с помощью оптического контрастирования в режиме Optical Enhancement (OE) при использовании эндоскопической системы Pentax; в — измерение длины короткого сегмента метаплазии в пищеводе с помощью дистального кончика биопсийного инструмента; г — длина сегмента метаплазии менее 1 см (режим осмотра в белом свете); д — измерение длины «языков» метаплазии с помощью дистального кончика биопсийного инструмента (узкоспектральный режим); е — длина дистальной части биопсийного инструмента 1 см.
Эпидемиология и факторы риска
Согласно данным нескольких крупных популяционных исследований, распространенность ПБ в Европе (Италия и Скандинавские страны) варьирует от 1,3 до 1,6% [15, 16]. В то же время исследование, проведенное в штате Миннесота (США), показало наличие признаков ПБ у 8,5% лиц старше 50 лет [17]. Согласно более ранним данным (2002 г.), распространенность ПБ среди лиц, обследованных в высокоспециализированных клиниках США, составляет от 8 до 17% [18]. Таким образом, можно предположить, что число больных ПБ только в США составляет 3—5 млн. Важно, что растущее с каждым годом число установленных диагнозов ПБ ассоциировано не только с истинным увеличением заболеваемости, но и с ростом объема эндоскопических исследований в популяции.
На сегодняшний день хорошо известны факторы риска развития ПБ:
— возраст старше 40—50 лет;
— мужской пол;
— европеоидная раса;
— ожирение по мужскому типу (центральное ожирение со значением индекса массы тела более 30 кг/м 2 увеличивает риск ПБ в 1,4 раза);
— длительный (5 лет и более) анамнез гастроэзофагеальной рефлюксной болезни (ГЭРБ) (изжога более 1 раза в неделю);
— курение (в настоящее время или в анамнезе);
— отягощенный по ПБ или АКП наследственный анамнез [19].
Известно, что развитие ПБ ассоциировано с генами MSR1, ASCC1 и CTHRC1 [20], CFTR, MSRA, BLK, KHDRBS2, TPPP/CEP72, TMOD1, SATB2, HTR3C/ABCC5 [21]. Такие данные с учетом удельного веса каждого полиморфизма возможно использовать в методах полигенного расчета для точного определения группы риска.
Интересно, что употребление алкоголя не относят к факторам риска развития ПБ или АКП. Более того, существуют данные, свидетельствующие о том, что небольшие дозы вина и инфицирование Helicobacter pylori могут оказывать даже некий протективный эффект в отношении развития ПБ [22, 23].
Считается, что в развитии ПБ определенную роль играет также изменение состава микробиоты пищевода. Так, известно, что у больных ПБ и АКП наблюдается снижение микробного разнообразия в слизистой оболочке пищевода. При ПБ описано относительное снижение доли бактерий родов Streptococcus, Bacteroides и Fusobacterium с одновременным повышением доли бактерий родов Prevotella, Actinobacillus, Veillonella и Leptotrichia [24].
Скрининг пищевода Баррета
Считается, что проведение скрининга и эндоскопического наблюдения за больными с ПБ позволяет свое временно выявлять участки дисплазии или раннего рака в сегменте метаплазированного эпителия, выполнять удаление их с помощью малоинвазивных и органосохраняющих эндоскопических методов. На сегодняшний день не существует убедительных доказательств целесообразности скрининговых мероприятий, однако ряд рандомизированных исследований демонстрируют высокую эффективность эндоскопического лечения ПБ с дисплазией в отношении предотвращения прогрессии в АКП, а также высокий показатель 5-летней выживаемости пациентов, у которых диагноз АКП установлен на ранней стадии [25].
Существующие на сегодняшний день рекомендательные документы, касающиеся стратегии диагностики, наблюдения, лечения ПБ, принятые ведущими европейскими, американскими, японскими и другими профессиональными сообществами, практически единогласно признают целесообразность проведения скрининговых мероприятий (ЭГДС) среди лиц, имеющих определенные факторы риска: мужской пол, возраст старше 50 лет, хронические симптомы ГЭРБ, центральное ожирение, курение в настоящее время или в анамнезе, отягощенная наследственность (см. таблицу) [26—30].
Таблица. Рекомендации по скринингу пищевода Баррета
- европеоидная раса;
- центральное ожирение;
- курение (в настоящее время или в анамнезе);
- отягощенный семейный анамнез (ПБ или АКП у родственников первой линии родства)
- возраст старше 50 лет;
- европеоидная раса;
- мужской пол;
- ожирение.
- ночные симптомы ГЭРБ;
- наличие диафрагмальной грыжи;
- повышенный ИМТ;
- курение;
- абдоминальное ожирение
Несмотря на общее понимание необходимости скрининга ПБ среди определенных групп населения, инвазивный характер эндоскопического исследования, его относительно высокая стоимость и необходимость проведения ЭГДС в условиях внутривенного наркоза не позволяют использовать его в качестве скринингового метода. Новая технология трансназальной эндоскопии с использованием ультратонкого эндоскопа, проводимого через носовой ход, значительно упрощает проведение исследования для пациента и врача, не требует седации, обеспечивает высокую специфичность, чувствительность в диагностике ПБ и в то же время безопасность и хорошую переносимость. Таким образом, трансназальная ЭГДС может быть рекомендована в качестве альтернативы традиционной ЭГДС при проведении скрининговых исследований, но не может рассматриваться как эндоскопия экспертного уровня для диагностики мельчайших структурных неопластических изменений слизистой оболочки сегмента метаплазии [26—31].
Рассматриваются также возможности применения малоинвазивных методов, таких как получение цитологического материала слизистой оболочки пищевода при помощи специальной губки (цитоспонж). Капсула с цитоспонжем внутри заглатывается пациентом, раскрывается и затем извлекается наружу путем потягивания за нить с образцами ткани, которые исследуются морфологическими, цитологическими и молекулярно-биологическими методами (определение маркеров метилированной ДНК). Сообщается о достаточно высокой чувствительности (78—100%) и специфичности (90—100%) данного подхода [30, 32].
Кроме того, разрабатываются специальные шкалы, учитывающие множественные факторы риска и позволяющие рассчитать персонифицированный риск для каждого конкретного пациента и, исходя из полученных данных, принимать решение о необходимости проведения скрининговых мероприятий [33].
Ведение больных с пищеводом Баррета
Терапия ингибиторами протонного насоса
Согласно большинству международных консенсусных документов и рекомендаций, на сегодняшний день недостаточно доказательств тому, что применение ингибиторов протонного насоса (ИПН) при ПБ вызывает регрессию кишечной метаплазии и предотвращает злокачественную прогрессию в АКП. Кроме того, существуют данные о том, что терапия ИПН может приводить к образованию так называемого «захороненного Баррета»: возникновению пласта многослойного плоского эпителия над слоем цилиндрического эпителия в пищеводе [34]. В связи с этим может быть обоснованным назначение ИПН (в стандартной дозе 1 раз в сутки) больным с ПБ, имеющим симптомы ГЭРБ (с целью их купирования) и/или эрозивно-язвенные повреждения слизистой оболочки пищевода. Назначение ИПН бессимптомным пациентам с целью предотвращения злокачественной прогрессии не показано [26—28, 35].
Однако можно ли ориентироваться на симптомы у больных с ПБ? Хорошо известно, что многие пациенты с ПБ имеют сниженную чувствительность пищевода к рефлюксу и зачастую не испытывают симптомов, что затрудняет принятие адекватного решения о применении ИПН [18, 36, 37]. Более того, ряд наблюдательных нерандомизированных исследований все-таки продемонстрировали возможность снижения риска прогрессии ПБ в аденокарциному пищевода на фоне терапии ИПН [38—40].
Для понимания целесообразности длительного приема ИПН пациентами с ПБ без симптомов рефлюксной болезни требуются дальнейшие исследования.
Роль функциональных методов исследования в диагностике и лечении пищевода Баррета
Широкое распространение тактики кислотосупрессивной терапии находится в явном противоречии с отсутствием тенденции к уменьшению числа больных с ПБ и неуклонным ростом заболеваемости АКП, что свидетельствует о необходимости учитывать другие (кроме воздействия кислоты желудочного сока) факторы патогенеза ГЭРБ и ПБ.
Методы функциональной диагностики пищевода (pH-импедансометрия пищевода и манометрия пищевода) дают возможность практикующему врачу оценить факторы, лежащие в основе развития заболевания в каждом отдельном случае, и обеспечить индивидуализацию подхода к лечению, оптимизировать схему медикаментозной терапии, грамотно принять решение о необходимости или недопустимости хирургического лечения, улучшить качество жизни и долгосрочный прогноз больных с ПБ [41].
Суточная pH-импедансометрия пищевода позволяет идентифицировать характер рефлюктата, попадающего в пищевод (кислые и щелочные рефлюксы), определяет продолжительность нахождения агрессивного болюса в пищеводе (экспозиция болюса) и скорость очищения пищевода от заброшенного рефлюктата (клиренс болюса), высоту распространения рефлюксов по ходу пищевода [41, 42].
Возможность метода pH-импедансометрии диагностировать некислые и щелочные рефлюксы особенно важна для пациентов с ПБ, в развитии которого большое значение имеют рефлюксы, содержащие желчь и другие компоненты сока двенадцатиперстной кишки. Выявление при проведении pH-импедансометрии щелочных рефлюксов (рис. 3), дуоденогастрального рефлюкса (ДГР), анацидного гастрита позволяет скорректировать терапию, пересмотреть необходимость назначения ИПН, решить вопрос о целесообразности приема секвестрантов желчных кислот, прокинетиков, препаратов урсодезоксихолевой кислоты, задуматься о проведении фундопликации.

Рис. 3. Фрагмент графика рН-импедансометрии (аппарат для импедансометрии «Гастроскан-ИАМ» ЗАО НПП «Исток-Система», Россия).
Эпизод щелочного рефлюкса: чашеобразное снижение импедансной кривой и повышение кривой pH более 7 в момент рефлюкса.
Кроме определения типа рефлюктата (кислый, щелочной) для адекватного лечения больных ПБ зачастую необходимо проведение еще одного метода функциональной диагностики — манометрии пищевода высокого разрешения. Возможности этого современного и высокотехнологичного метода включают измерение давления покоя верхнего и нижнего пищеводного сфинктеров, полноты их раскрытия в ответ на глоток (остаточное давление), частоты и длительности преходящих расслаблений нижнего пищеводного сфинктера, интенсивности сокращений грудного отдела пищевода, определение расположения верхнего и нижнего пищеводного сфинктеров (расстояние от ноздрей), длины пищевода, выявление грыжи пищеводного отверстия диафрагмы и определение ее точных размеров [42].
На сегодняшний день многочисленными клиническими и экспериментальными исследованиями убедительно показано, что ПБ в большинстве случаев протекает на фоне серьезных нарушениий моторики пищевода, таких как неэффективная моторика (рис. 4), отсутствие сократимости (рис. 5), фрагментированная перистальтика пищевода (рис. 6), приводящих к замедлению пищеводного клиренса, увеличению времени экспозиции агрессивного рефлюктата в пищеводе (особенно в горизонтальном положении) [42—45]. Выявление данных нарушений моторики имеет значение при выборе тактики лечения.

Рис. 4. Манометрия пищевода у больного гастроэзофагеальной рефлюксной болезнью: неэффективная моторика пищевода (сокращения грудного отдела пищевода слабой интенсивности).

Рис. 5. Манометрия пищевода у больного с пищеводом Баррета: отсутствие сократимости в грудном отделе пищевода.

Рис. 6. Манометрия пищевода: фрагментированная перистальтика пищевода.
Неэффективная моторика и особенно отсутствие сократимости грудного отдела пищевода могут служить предикторами послеоперационной дисфагии в случае хирургического лечения (проведения фундопликации). Имеющиеся на сегодняшний день данные исследований по лечению больных ГЭРБ с отсутствием сократимости пищевода свидетельствуют о более благоприятных результатах частичной фундопликации (по Тупе) по сравнению с классической операцией по Ниссену [46, 47].
Согласно современным рекомендациям, лечение больных с ГЭРБ (в том числе с ПБ) на фоне неэффективной моторики пищевода включает назначение высокоэффективных ИПН и соблюдение определенных условий при приеме пищи: тщательно пережевывать и запивать пищу водой, отдавать предпочтение полужидкой пище, есть в вертикальном положении, не ложиться после еды, не принимать горизонтальное положение в течение двух часов после приема пищи [48, 49]. В ряде исследований продемонстрировано некоторое улучшение моторики пищевода на фоне применения прокинетиков: пиридостигмина бромида, буспирона, метоклопрамида, эритромицина, цизаприда и тегасерода, однако наличие побочных эффектов ограничивает использование данных препаратов для лечения больных ПБ на фоне неэффективной моторики пищевода.
Прокинетические препараты, разрешенные для длительного применения (итоприд и прукалоприд), не оказывают существенного влияния на силу и продолжительность сокращений гладкомышечного отдела пищевода, в связи с чем их применение при неэффективной моторике пищевода нерационально [50—58].
Антирефлюксное хирургическое лечение при пищеводе Баррета
Существует мнение, что проведение антирефлюксных операций может предотвратить прогрессирование ПБ в АКП. Тем не менее накопленные к настоящему моменту данные крупномасштабных клинических исследований доказывают обратное [59]. Так, большое популяционное когортное исследование, проведенное в Швеции среди больных ГЭРБ, не показало хоть сколько-нибудь значимого канцерпротективного эффекта антирефлюксных операций [60]. Согласно результатам данной работы, стандартизированный показатель заболеваемости АКП в группе пациентов, подвергшихся хирургическому лечению ГЭРБ, составил 14,1 (95% ДИ 8,0—22,8), в то время как у пациентов, находящихся на медикаментозной терапии, этот показатель оказался значительно ниже — 6,3 (95% ДИ 4,5—8,7). В другом когортном исследовании также не обнаружено преимуществ оперативного лечения ГЭРБ в отношении предотвращения развития АКП: ежегодная частота развития опухоли составила 0,072% среди прооперированных пациентов и 0,04% среди пациентов, находящихся на медикаментозном лечении [61].
Аналогичная картина наблюдается и в когорте больных с ПБ. Метаанализ, сравнивающий частоту развития АКП среди больных ПБ, принимающих антисекреторные препараты, и больных после фундопликации, не выявил статистически значимых различий [62]. В систематическом обзоре, проведенном E. Chang и соавт., также не обнаружены преимущества хирургического лечения в отношении предотвращения злокачественной прогрессии у больных с ПБ [63].Таким образом, на сегодняшний день можно с уверенностью утверждать, что хирургическое антирефлюксное лечение не снижает риск развития АКП у больных с ГЭРБ и ПБ.
Эндоскопическая диагностика и наблюдение
Целью эндоскопического наблюдения за больными с ПБ является раннее выявление дисплазии и/или аденокарциномы, позволяющее провести своевременное радикальное лечение, по возможности с использованием малоинвазивных методов. Стандартом своевременной диагностики предраковых изменений и раннего рака в сегменте ПБ является выполнение тщательного эндоскопического осмотра с проведением прицельной биопсии всех видимых патологических участков с признаками неоплазии, а также рандомизированной биопсии (рис. 7). Рандомизированная биопсия выполняется через каждые 1—2 см по всей длине сегмента ПБ в 4 точках по окружности (Сиэтлский протокол) [28].

Рис. 7. Выполнение стандартного протокола биопсии (Сиэтлский протокол).
а — схема рандомизированных биопсий, выполняемых по окружности пищевода Баррета через каждые 2 см при наличии длинного сегмента метаплазии и через каждый 1 см при коротком сегменте (не более 3 см) или в случаях, когда ранее у пациента выявлена дисплазия; б — биоптаты правильно ориентируют и помещают в отдельные кассеты или контейнеры, маркируют их соответственно месту забора материала 4 знаками xxyy. Первые два знака маркировки (xx) означают расстояние от резцов до точек забора биоптатов, вторые два (yy) — расположение биоптата из видимого патологического участка по условному циферблату (от 01 до 12); значение yy — 00 указывается для рандомизированной биопсии в 4 точках по окружности.
Эффективность обнаружения патологических видимых участков неоплазии повышается при использовании контрастных красителей (индигокарминовый краситель) и уксусной кислоты (1,5—3% раствор), наносимых на поверхность слизистой оболочки пищевода с помощью спрей-катетеров. Контрастирование уксусной кислотой вызывает обратимую химическую реакцию с протеинами цитоплазмы клеток цилиндрического эпителия (ацетилирование), в результате чего эпителий после нанесения на его поверхность раствора уксусной кислоты приобретает белесоватый оттенок, а очаги неоплазии остаются красными на этом фоне [64] (рис. 8). Методика является эффективной и достаточно безопасной, однако требует определенных временных затрат на распыление раствора, последующего удаления его из просвета верхних отделов пищеварительного тракта для предотвращения аспирации содержимого в дыхательные пути.

Рис. 8. Выявление и характеристика патологических участков в сегменте метаплазии после аппликации 1,5% раствора уксусной кислоты на поверхность слизистой оболочки.
а — эндоскопическая картина до нанесения контрастирующего вещества; б — процесс распыления уксусной кислоты с помощью спрей-катетера; в — обнаружение патологического участка неоплазии (отмечен стрелками) после контрастирования уксусной кислотой: патологический участок остается красным на фоне белесоватой окружающей слизистой оболочки.
В последние годы в арсенале практического врача появились новые возможности, улучшающие распознавание неопластических изменений слизистой оболочки пищевода, такие как виртуальная оптическая и цифровая хромоскопия с использованием технологий узкоспектрального осмотра: NBI, i-scan или BLI. По данным опубликованного в 2013 г. систематического обзора и метаанализа, применение какого-либо из перечисленных дополнительных методов визуализации увеличивает частоту выявления дисплазии и неопластических изменений до 33% [65].
Метод конфокальной лазерной эндомикроскопии с большим увеличением изображения (рис. 9) позволяет исследовать слизистую оболочку на микроскопическом уровне в режиме реального времени, дифференцировать метапластические и диспластические изменения без проведения гистологического исследования (оптическая биопсия).

Рис. 9. Пирамида прогрессии пищевода Баррета в аденокарциному пищевода с учетом факторов и степени риска.
Рисунок адаптирован из S. Parasa и соавт. [79].
Одной из новинок в скрининге и наблюдении пациентов с ПБ стала методика взятия биопсийного материала с помощью браш-биопсии с использованием специальной жесткой щетки, способной получить материал для гистологического исследования и предоставить образцы клеток для компьютерного трехмерного анализа. Технология предполагает автоматизированный отбор наиболее подозрительных в отношении неоплазии образцов для последующей оценки экспертом-патоморфологом [66].
Обнаружение дисплазии является ключевой задачей эндоскопического исследования, так как именно дисплазия существенно повышает риск развития АКП. Предполагаемый ежегодный риск прогрессирования в аденокарциному у пациентов с ПБ без дисплазии составляет от 0,12 до 0,33% [67, 68], у пациентов с дисплазией низкой степени он выше и может достигать 1,9% [69]. Ежегодный риск прогрессирования ПБ с дисплазией высокой степени наиболее высокий и достигает 7% [70, 71].
Диагноз дисплазии (низкой или высокой степени) должен быть подтвержден экспертными патологами, специализирующимися на заболеваниях желудочно-кишечного тракта, поскольку степень большинства дисплазий, диагностируемых в неспециализированных центрах экспертными гастроинтестинальными морфологами, может быть не подтверждена, а в ряде случаев дисплазия может быть полностью исключена.
Данные недавних рандомизированных контролируемых [8] и когортных исследований [72] стали основанием для изменения рекомендаций по ведению пациентов с ПБ и дисплазией. Теперь таким пациентам показано эндоскопическое удаление участка дисплазии, а также поэтапная аблация всего сегмента метаплазии. Однако в случае сопутствующих заболеваний, ограничивающих ожидаемую продолжительность жизни пациента, а также в отсутствие согласия на проведение операции у пациентов с дисплазией низкой степени возможна выжидательная тактика с проведением активного наблюдения (каждые 6—12 мес) [73]. Пациентам с ПБ без дисплазии эндоскопическое лечение не рекомендовано.
К сожалению, в реальной клинической практике показатели своевременного выявления дисплазии далеки от идеала. Связано это с несоблюдением стандартов осмотра и проведения биопсии [74, 75] и низкой степенью согласия среди патологов в дифференциальной диагностике дисплазии и воспалительных изменений эпителия [76]. Результаты недавно проведенного систематического обзора и метаанализа более чем 20 исследований показали, что, хотя регулярное эндоскопическое наблюдение и связано с выявлением АКП на ранних стадиях, в настоящее время это не оказывает значительного влияния на показатели смертности от АКП [77].
Стратификация риска прогрессирования пищевода Баррета
Наличие дисплазии, подтвержденной при гистологическом исследовании биоптатов, является наиболее важным показателем риска прогрессирования ПБ в аденокарциному. Кроме дисплазии учитываются и другие факторы риска, такие как возраст старше 50 лет, мужской пол, курение, длина сегмента метаплазии более 3 см и прочее [78].
В одном из последних исследований, проведенном группой профессора Пратика Шармы (P. Sharma), проанализированы факторы риска прогрессии ПБ в аденокарциному и создана шкала прогрессии ПБ (PIB — progression in BE). Эта шкала может стать основой для создания системы персонифицированного наблюдения и лечения пациентов с ПБ [79]. Каждый имеющий значение фактор оценивается определенным числом баллов, в результате чего создается пирамида прогрессии в аденокарциному (см. рис. 9) [78].
Оценка корреляции длины сегмента метаплазии и частоты выявления дисплазии в ПБ проведена в нашем собственном исследовании по длительному наблюдению 172 пациентов с ПБ, выполненном в ГБУЗ Ярославской области «Клиническая онкологическая больница». У пациентов с длинным сегментом ПБ (более 3 см) дисплазия выявлена в 16,3%, в то время как в коротком сегменте очаги дисплазии удалось обнаружить только у 5% пациентов (рис. 10).

Рис. 10. Распространенность дисплазии в пищеводе Баррета по данным регистра эндоскопического отделения ГБУЗ Ярославской области «Клиническая онкологическая больница».
Выделение групп низкого и высокого риска представляется оправданным с точки зрения разработки персонифицированных программ наблюдения и лечения, отбора пациентов для проведения аблации с учетом повышенного риска появления неопластических изменений.
Эндоскопическое лечение
Отбор пациентов и алгоритм действий
Лечение пациентов с ПБ без дисплазии включает в себя терапию ГЭРБ, направленную на купирование симптомов заболевания, заживление эрозивно-язвенных повреждений слизистой оболочки пищевода, предотвращение развития предраковых изменений (дисплазии).
Алгоритм ведения пациентов с ПБ при наличии дисплазии эпителия определен в новых европейских и американских рекомендациях [26—29]. Основные положения алгоритма:
— профилактическая аблация ПБ без дисплазии не должна выполняться (ввиду крайне низкого риска развития аденокарциномы);
— диагноз дисплазии эпителия любой степени в ПБ, включая наличие морфологических изменений, подозрительных или неопределенных в отношении дисплазии (indefinite for dysplasia), требует подтверждения вторым морфологом, имеющим достаточный опыт в данной области (морфологом-экспертом);
— пациенты с видимыми при эндоскопическом исследовании патологическими участками слизистой оболочки, подтвержденными при биопсии как дисплазия или ранний рак, должны быть направлены в экспертный центр для проведения дальнейшей диагностики и лечения;
— пациенты с дисплазией высокой степени, подтвержденной вторым экспертом-морфологом, должны быть направлены в экспертный центр для уточняющей диагностики с использованием техники с высокими разрешающими возможностями;
— все видимые при эндоскопическом исследовании патологические участки должны быть удалены с помощью эндоскопических методов с целью получения материала для морфологического исследования и последующего стадирования;
— пациенты, которым выполнено эндоскопическое удаление видимых патологических образований, имеющих различную степень дисплазии или неоплазии, должны быть подвергнуты дополнительному эндоскопическому лечению, заключающемуся в аблации оставшегося сегмента цилиндроклеточной метаплазии с использованием различных технологий (радиочастотная аблация или аргоноплазменная гибридная технология аблации).
Эндоскопическая резекция слизистой оболочки
При эндоскопической резекции слизистой оболочки (ЭРС) возможно получение большого фрагмента слизистой оболочки, благодаря чему подробно исследуется как слизистый, так и подслизистый слой, уменьшается число артефактов. Недостаточная степень согласия среди патологоанатомов при установлении диагноза дисплазии в биоптатах, полученных при стандартной биопсии с помощью эндоскопических щипцов, значительно улучшается при исследовании более крупных по размеру эндоскопических пострезекционных фрагментов ткани [80].
Кроме того, возможны точное T-стадирование (прежде всего дифференцирование T1a (в пределах слизистой оболочки) и T1b (инвазия АКП в подслизистый слой)) и оценка краев резецированного участка (латерального и вертикального) [81]. При оценке радикальности эндоскопической операции важно оценивать степень дифференцировки опухоли, отсутствие опухолевых клеток в вертикальном и горизонтальном краях резекции, а также отсутствие лимфоваскулярной инвазии.
Только при таких условиях ЭРС может считаться курабельной. Наиболее распространенными методами ЭРС в сегменте ПБ являются методики «аспирации и резекции» (suck-and-cut techniques): с использованием дистального колпачка и лигатора (рис. 11, 12). Обе методики одинаково эффективны и безопасны для удаления нодулярных участков ПБ.

Рис. 11. Этапы выполнения эндоскопической резекции участка неоплазии в сегменте пищевода Баррета с помощью лигирующего устройства Duette, COOK Medical, США.
а — маркировка границ патологического участка для выполнения радикальной резекции; б, в — на дистальной части эндоскопа установлен и фиксирован лигатор, используемый для эндоскопической резекции; г, д — этап операции, аспирация патологического участка в полость лигатора; е, ж — наложение лигатуры под основание патологического участка с образованием псевдополипа; з, и — резекция патологического участка с помощью эндоскопической петли; к — пострезекционный препарат; л — посткоагуляционный язвенный дефект в области выполненной резекции.

Рис. 12. Этапы эндоскопического удаления патологического участка пищевода Баррета с помощью методики колпачковой резекции с дистальным колпачком (EMR-С, Olympus, Япония).
а — патологический участок слизистой оболочки (отмечен стрелками) с признаками неоплазии в сегменте пищевода Баррета (узкоспектральный режим осмотра NBI с оптическим увеличением изображения); б — участок слизистой оболочки с неполной кишечной метаплазией, фокусом дисплазии низкой степени, окраска гематоксилином и эозином, ×100; в, г — инъекция в подслизистый слой в области удаляемого участка физиологического раствора с индигокарминовым красителем и адреналином для создания гидравлической «подушки» и предотвращения перфорации мышечного слоя стенки пищевода; д, е — аспирация патологического участка внутрь колпачка; ж, з — затягивание эндоскопической петли у основания патологического участка с последующей резекцией патологического участка с помощью эндоскопической петли; и, к — эндоскопический гемостаз после проведенной резекции с помощью коаграспера Olympus; л — посткоагуляционный дефект без признаков продолжающегося кровотечения; м — пострезекционный препарат удаленного патологического участка слизистой оболочки, фиксированный к плате иглами; н — гистологическое исследование препарата: фрагмент слизистой оболочки пищевода с диффузной кишечной метаплазией, фокусы регенерации эпителия, диспластические изменения не выявлены, окраска гематоксилином и эозином, ×100.
Эндоскопическое удаление участка неоплазии методом эндоскопической подслизистой диссекции позволяет резецировать патологический участок размером более 1,5 см единым фрагментом, что в большей степени обеспечивает радикальность операции с отсутствием клеток опухоли в краях пострезекционного фрагмента с опухолью (R0 резекция) по сравнению с ЭРС при опухолях такого размера [82] (рис. 13). Однако выбор между продолжением наблюдения за пациентом после эндоскопического лечения или последующим направлением на эзофагэктомию основан в большей степени на глубине инвазии опухоли, данные о которой могут быть получены равно как при ЭРС, так и при диссекции. Метастатическое поражение лимфоузлов редко встречается при АКП T1a стадии (менее 2%), что позволяет считать эндоскопическую терапию достаточной, но значительно чаще при АКП T1b стадии (от 20 до 30%), что определяет эзофагэктомию как основной метод лечения, за исключением пациентов с тяжелой сопутствующей патологией и наиболее «благоприятными» гистологическими характеристиками удаленной опухоли, включая степень дифференцировки и отсутствие лимфоваскулярной инвазии.

Рис. 13. Этапы выполнения эндоскопической операции методом диссекции по подслизистому слою.
а — участок неоплазии в сегменте пищевода Баррета, обнаруженный при проведении эндоскопии экспертного уровня с помощью узкоспектрального светового режима в комбинации с оптическим увеличением изображения (эндоскопическая система Evis Exera III (Olympus, Япония), эндоскоп GIF-HQ 190 (Olympus, Япония), стрелками отмечена четкая демаркационная линия патологического участка с нарушенным рисунком поверхности эпителия и наличием патологического сосудистого рисунка; б, в — этапы эндоскопической диссекции с помощью нового эндоскопического ножа (г) Dual knife J™, Olympus, Япония, включающие циркулярный разрез слизистой оболочки вокруг границ опухоли и последующую диссекцию подслизистого слоя после введения в него раствора гиалуроновой кислоты; д — посткоагуляционный язвенный дефект слизистой оболочки в зоне операции размером 40×35 мм; е — макропрепарат удаленной опухоли с окружающей слизистой оболочкой, фиксированный иглами на плате; ж, з — гистологическое исследование препарата: фокус поверхностной аденокарциномы в центре фрагмента (стрелки), края интактны (ж), тубулярная высокодифференцированная аденокарцинома (з) с инвазией в пределах собственной и мышечной пластинки слизистой оболочки (стрелки), с эрозией на поверхности (1) G1, m3, 8 mm, L0, V0, VM0, HM0, R0 (большое увеличение, окраска гематоксилином и эозином).
Эндоскопическое удаление патологических участков в ПБ связано с определенным риском развития осложнений. К ним относятся: перфорация (менее 1% для ЭРС и 1—3% для диссекции), кровотечение (5%) и формирование стриктур. Риск формирования стриктур невелик, когда зона резекции составляет менее 50% окружности пищевода. Стриктуры успешно лечатся с помощью дилатации [83].
Если при гистологическом исследовании удаленного фрагмента обнаруживается дисплазия низкой, высокой степени или АКП (гистологическая стадия — T1a без лимфоваскулярной инвазии и с негативными вертикальным и латеральными краями), рекомендуется эндоскопическая аблация всего сегмента ПБ. Возможность проведения аблации может быть рассмотрена у пациентов с высокодифференцированной T1b АКП с поверхностной подслизистой инвазией (менее 500 мм, sm1), без лимфоваскулярной инвазии и у пациентов с высоко- и умеренно дифференцированной АКП, которым невозможно выполнение хирургического вмешательства [84]. Однако такое решение должно приниматься междисциплинарным консилиумом совместно с онкологами, хирургами и патоморфологами [40].
Методики аблации
После резекции видимых патологических участков элиминация оставшейся ткани ПБ имеет важное значение в снижении риска рецидива неоплазии. Радиочастотная аблация (РЧА) остается наиболее часто выполняемой эндоскопической процедурой для аблации ПБ благодаря ее высокой эффективности и безопасности.
РЧА — это термический метод аблации слизистой оболочки с использованием биполярных электродов, расположенных на циркулярных (баллонных) или фокусных (катетерах) устройствах для выполнения аблации [85]. Многоцентровое рандомизированное контролируемое исследование в США показало, что РЧА у 81% пациентов с дисплазией высокой степени и у 91% пациентов с дисплазией низкой степени обеспечила полную эрадикацию дисплазии в течение 12 мес со статистически значимым снижением прогрессирования до АКП [7]. Новые методики аблации ПБ, такие как баллонная криотерапия, основанная на применении закиси азота [86], и гибридная аргоноплазменная коагуляция, активно применяются в настоящее время в странах Европы. В нашей стране гибридная аргоноплазменная аблация является методикой выбора, преимущественно у пациентов с коротким сегментом метаплазии (рис. 14).

Рис. 14. Этапы эндоскопической аблации сегмента пищевода Баррета с участком дисплазии слизистой оболочки низкой степени с помощью новой гибридной аргоноплазменной технологии APC, ERBE Elektromedizin, Германия.
а, б — диагностика пищевода Баррета (короткий сегмент) в стандартном белом световом режиме и с помощью узкоспектрального режима NBI; в, г — схематичное изображение этапов аблации специальным гибридным зондом, обеспечивающим подачу физиологического раствора в подслизистый слой (для создания гидравлической подушки и предотвращения повреждения мышечного слоя стенки пищевода) и аргоноплазменную аблацию метапластического эпителия; д, е — применение гибридного зонда ERBE и аблация сегмента метаплазии с формированием посткоагуляционного дефекта слизистой оболочки; ж — полная эпителизация участка аблации вновь образованным плоским эпителием; з — биопсия нового плоского эпителия для исключения оставшихся очагов кишечной метаплазии под ним; и — биоптат слизистой оболочки пищевода с выстилкой многослойным плоским эпителием без признаков «захороненного Баррета».
Трудности эндоскопического лечения пищевода Баррета
Аблация сегмента метаплазии высокоэффективна у большинства пациентов. В тех случаях, когда не удается достичь полной регрессии сегмента цилиндроклеточной метаплазии после 3—5 сеансов аблации, необходимо подтверждение адекватного контроля кислотного рефлюкса с помощью pH-метрии и удаление оставшейся части сегмента метаплазии другими методиками, например эндоскопической резекцией или локальной аргоноплазменной аблацией. Криотерапия может быть рассмотрена в качестве перспективной методики в ведении таких пациентов [87].
Заключение
Примерно 95% случаев аденокарциномы пищевода диагностируется у больных с пищеводом Баррета. Поэтому основную роль в профилактике и ранней диагностике железистого рака пищевода играет диагностика и эффективное лечение пищевода Баррета [88]. Высококвалифицированные эндоскопическое и морфологическое исследования лежат в основе правильной диагностики этого патологического состояния. От врача-эндоскописта, его знаний, методических навыков, правильности интерпретации выявленных изменений слизистой оболочки, опыта и, наконец, технического оснащения зависит своевременная и отвечающая современным критериям диагностика пищевода Баррета, диспластических изменений слизистой оболочки и ранних форм аденокарциномы пищевода [39].
В последнее время значительный прогресс достигнут в разработке подходов к выявлению пищевода Баррета и ассоциированной с ним дисплазии, а также в эффективной эндоскопической терапии дисплазии и ранних стадий аденокарциномы пищевода. Для достижения оптимальных результатов эндоскопическое лечение пищевода Баррета следует проводить в экспертных центрах. Задачи, которые еще предстоит решить в ближайшее время, включают внедрение в широкую клиническую практику новых технологий эндоскопического наблюдения и лечения, персонифицированный подход к ведению пациентов, учитывающий все факторы риска прогрессии пищевода Баррета в аденокарциному, генетические биомаркеры и особенности патогенеза этого заболевания.
Источник: www.gastroscan.ru
Пищевод Барретта и профилактика аденокарциномы пищевода
Профессор Эрдес С.И.: – Уважаемые слушатели, уважаемые коллеги, продолжаем наш разговор о канцеропревенции пищевода. И переходим к рассмотрению вопросов, касающихся непосредственно особенностей такой грозной патологии как пищевод Барретта. Позвольте предоставить слово для следующего доклада профессору Шептулину Аркадию Александровичу для сообщения «Пищевод Барретта и профилактика аденокарциномы пищевода».
Профессор Шептулин А.А.: – Добрый день, многоуважаемые коллеги.
(00:35) Заставка: Пищевод Барретта и профилактика аденокарциномы пищевода.
Профессор Шептулин А.А.: – Тема моей краткой лекции: «Пищевод Барретта и профилактика аденокарциномы пищевода». Я начну с демонстрации клинического примера – примера больного, который не так давно был в нашей клинике.
Пациенту 49 лет. Он поступил с достаточно классическим, часто встречающимся комплексом жалоб: тошнота, рвота по утрам, дискомфорт в подложечной области, неприятный вкус во рту и общая слабость. Сам больной считает себя таковым на протяжении трех лет, когда на фоне изжоги у него появилась тошнота и рвота, а при гастроскопии была выявлена картина эрозивного гастрита.
Он принимал с хорошим эффектом ингибиторы протонной помпы, и продолжал работать. Но более тщательный расспрос показал, что впервые изжогу больной отметил в 30-летнем возрасте, то есть 20 лет назад. Это очень показательно, потому что большинство больных, которые испытывают изжогу, лечатся самостоятельно по совету друзей, знакомых – так называемый «телефонный рефлюкс».
А между тем, гастроэзофагеальная рефлюксная болезнь за это время существенно прогрессирует. И ухудшение у него было с августа 2010 года (этот случай относится к тому году) – это было буквально за два месяца до поступления. На гастроскопии была выявлена язва пищевода, и вновь назначены ингибиторы протонной помпы.
Что можно сказать об анамнезе жизни? Пациент, хоть он поступил и в солидную клинику, относится к не самым высшим слоям общества, мягко говоря. Он работает электромонтером, разведен, злоупотребляет алкоголем. Количество, которое было указано – 150-200 мл, скорее всего, заниженное, причем ежедневное количество. Курит по 20 сигарет в день.
О социальном статусе и его уровне говорит хотя бы то, что у него во рту не было ни одного зуба, и он даже не удосужился протезировать. Он так вот и питался, шамкая беззубым ртом. Тем не менее, ориентируясь на результаты предшествующего обследования, мы ему поставили диагноз «рефлюкс-эзофагита IV стадии» по классификации Savary-Miller, поскольку у него была пептическая язва пищевода. И так как больной – заядлый курильщик, у него были проявления хронического обструктивного бронхита и эмфизема легких.
В общем анализе крови, как свойственно больным с обструктивным бронхитом, у него был повышен уровень гемоглобина – вторичный эритроцитоз. У него присутствовал высокий цветовой показатель, и были увеличены размеры эритроцитов – это отражает скрытый дефицит витамина В12 и фолиевой кислоты, и считается одним из косвенных маркеров хронического алкоголизма.
В анализе мочи ничего особенного нет, анализ кала отрицательный. Удивляет биохимический анализ крови – идеальное состояние печеночных ферментов и ГГТ (потом доказывай, что алкоголь влияет на печень). Ничего особенного при ультразвуковом исследовании со стороны печени, поджелудочной железы и желчного пузыря обнаружено не было.
Но когда была сделана гастроскопия, были обнаружены характерные «языки пламени» – это то, что свойственно пищеводу Барретта: перестройка эпителия по кишечному типу. Также мы смогли пронаблюдать пептическую язву, конвергенцию складок, но, скорее всего, эта язва достаточно быстро зарубцуется. И наш очень опытный эндоскопист эту картину расценил как эрозивно-язвенный рефлюкс-эзофагит, осложненный развитием пищевода Барретта. Мы знаем, к чему может привести пищевод Барретта. Эндоскопист взял семь фрагментов их краев и дна язвы.
Было назначено наиболее интенсивное лечение эзофагита, которое мы применяем при осложненных формах: двухразовое применение ингибиторов протонной помпы, в частности «Париета», который обладает целым рядом преимуществ; комбинация с Н2-блокатором (вечерний прием), которая дает, как считается, самый сильный эффект. И в качестве симптоматической терапии – «Альмагель» и «Мотилиум».
Довольно быстро эта пептическая язва абдоминальной части пищевода зарубцевалась, сохранялись явления рефлюкс-эзофагита. Больной чувствовал себя прекрасно и настаивал на выписке, уверяя, что его давно заждались друзья. Тем не менее мы ему сказали, что надо подождать гистологическое заключение.
И мы увидели, что действительно подтвердилось наличие пищевода Барретта с перестройкой эпителия по кишечному типу, картина классического эрозивно-язвенного эзофагита. Но что печально, на фоне этого эзофагита были выявлены атипичные клетки. И морфолог интерпретировал эту картину как муцинозную аденокарциному. Соответственно, мы стали дообследовать.
Мы сделали рентген и выявили дефект наполнения. И клинический диагноз был изменен на рак абдоминального отдела пищевода – инфильтративно-язвенная форма. И в качестве фонового заболевания была указана гастроэзофагеальная рефлюксная болезнь: недостаточность кардии, и пищевод Барретта.
Этот пример показателен тем, что больной за 20 лет болезни, по поводу которой он не обращался, не лечился, прошел все стадии, которые проходит гастроэзофагеальная рефлюксная болезнь: стадия эрозивного эзофагита, стадия пищевода Барретта и закончил развитием аденокарциномы. Ссылаясь на рекомендации Американского колледжа гастроэнтерологов, можно дать определение, что такое «пищевод Барретта» – это замещение плоского эпителия дистального отдела пищевода цилиндрическим эпителием, которое выявляется при эндоскопии и дальше подтверждается при гистологическом исследовании обнаружением в этом участке кишечной метаплазии.
Данные об эпидемиологии, частоте и распространенности пищевода Барретта расходятся: 6% среди всех больных с симптомами диспепсии; 8% среди всех больных с изжогой. Но более правдоподобными являются данные – 10-15% среди всех больных гастроэзофагеальной рефлюксной болезнью (только подчеркнем) эрозивной формы. Применительно ко всем пациентам, включая неэрозивные формы, пищевод Барретта составляет примерно 3%. Весьма показательным является то, что частота пищевода Барретта значительно увеличивается, параллельно с увеличением распространенности гастроэзофагеальной рефлюксной болезни.
К фактору риска пищевода Барретта относится и метаболический синдром. Наличие этого синдрома повышает риск развития пищевода Барретта в 2 раза, потому что ожирение приводит к увеличению содержания периэзофагеальной жировой ткани. И за счет освобождения из нее цитокинов и хемокинов способствует развитию воспалительных изменений слизистой оболочки пищевода.
И это объясняет достаточно низкую частоту пищевода Барретта в Японии. В отличие, скажем, от Соединенных Штатов в Японии сложно найти тучного японца. Распространенность ожирения в Соединенных Штатах – около 60%, избыточный вес, а в Японии – 5%.
Хотелось бы обратить внимание на риск малигнизации при пищеводе Барретта. В целом он невысокий – мета-анализ 25 работ показал, что риск малигнизации составляет 0,5% в год. Но это общий риск, и он может быть разным у разных больных. Прежде всего, различается риск малигнизации при наличии дисплазии и при ее отсутствии.
В частности, риск развития аденокарциномы у больных без дисплазии невысок, но зависит от протяженности: короткий сегмент – меньше 3 см, и длинный сегмент – перестройка пищевода Барретта. Мы видим, что при большей протяженности поражения риск малигнизации выше. Также риск малигнизации зависит от наличия дисплазии.
Он сравнительно невысокий при дисплазии низкой степени, и существенно возрастает, если мы сталкиваемся уже с дисплазией высокой степени. Ежегодный риск развития дисплазии высокой степени при пищеводе Барретта составляет 1%. Действительно, обследовали и подвергли динамическому наблюдению почти 8 тысяч больных с пищеводом Барретта на протяжении 25 лет.
И 1% в год за это время у 20-25% больных – развилась дисплазия высокой степени. Риск развития дисплазии высокой степени зависит от длинны сегмента пищевода Барретта. У тех больных, у которых в течение нескольких лет развилась дисплазия высокой степени или аденокарцинома, длинна сегмента Барретта была 6 см, у тех, у кого прогрессирования не было – только 3 см. Также риск малигнизации зависит от количества очагов дисплазии. При наличии мультифокальной дисплазии, то есть многих очагов, риск развития аденокарциномы в 3 раза выше, чем в тех случаях, когда один очаг перестройки.
«Золотой стандарт» диагностики пищевода Барретта – это эзофагогастродуоденоскопия с множественной биопсией, которая делается через каждые 2 см, таким образом, берется до восьми биоптатов. Что касается дополнительных методов, они играют чисто вспомогательную роль. Наблюдаются трудности скрининга больных с пищеводом Барретта по следующим причинам.
Во-первых, если есть клинические симптомы, то они совершенно не отличаются от клинических симптомов при других формах ГЭРБ, а у половины больных с пищеводом Барретта вообще отсутствуют клинические симптомы. И даже характерная эндоскопическая картина – «языки пламени», они обнаруживаются не у всех больных. Тактика ведения таких пациентов – все определяется наличием или отсутствием дисплазии. Если это просто пищевод Барретта, но нет дисплазии эпителия, то таким больным необходимо дважды сделать в течение года биопсию.
И если дисплазия отсутствует, дальше они подвергаются динамическому контролю с эндоскопическим исследованием раз в три года. Если у пациентов выявлена дисплазия низкой степени, то проводится повторное исследование через шесть месяцев. Диагноз подтверждается независимым экспертом-патологом.
И если сохраняется дисплазия низкой степени – показано динамическое наблюдение с повторным эндоскопическим исследованием с интервалом в один год. И, наконец, если у пациентов дисплазия высокой степени, то повторно в течение первых трех месяцев в динамике берутся множественные биопсии для исключения аденокарциномы. И если диагноз «дисплазия высокой степени» подтверждается – решается вопрос о применении эндоскопических или хирургических методов исследования.
Такая калечащая операция – эзофагэктомия, которую раньше делали при пищеводе Барретта и высокой дисплазии, в настоящее время уже не рассматривается. Эндоскопические и хирургические методы лечения дисплазии высокой степени – это, прежде всего, фотодинамическая терапия, часто в комбинации с приемом ингибиторов протонной помпы.
Она эффективна почти у 80% больных и снижает риск развития аденокарциномы на 50%. Термоаблация с помощью аргоновой плазменной коагуляции тоже оказывается эффективной более чем у 80% больных. К методам лечения относится и радиочастотная абляция, правда, в позднем периоде при этом возможно развитие стриктур пищевода, и криоаблация. Однако по рекомендации консенсуса экспертов в настоящее время лучшим методом лечения больных пищеводом Барретта с дисплазией высокой степени является эндоскопическая резекция слизистой оболочки пищевода. Она может комбинироваться с радиочастотной абляцией или криоаблацией.
Что же дает дополнительный прием ингибиторов протонной помпы при пищеводе Барретта? Прежде всего, если больные с ГЭРБ длительное время постоянно принимают ингибиторы протонной помпы, то сам по себе риск развития пищевода Барретта снижается в 2 раза.
Кроме того, были получены материалы при применении «Париета», которые показали, что длительный прием способствует предупреждению дальнейшего прогрессирования ГЭРБ и развития ее рецидивов. Кроме того, длительный – более 10 лет прием ингибиторов протонной помпы снижает риск развития дисплазии высокой степени и аденокарциномы пищевода. И что интересно, хотя действительно полностью восстановления нормальной структуры не происходит, обзор девяти когортных исследований с длительностью приема ингибиторов протонной помпы до 13 лет показал, что более чем у половины больных происходит восстановление отдельных островков нормального многослойного плоского эпителия. Тем самым протяженность метаплазированной слизистой оболочки пищевода уменьшается.
И, наконец, активная антисекреторная терапия ингибиторами протонной помпы способствует лучшей реэпителизации слизистой оболочки пищевода после радиочастотной терапии. Ну и, к сожалению, «ложка дегтя в бочке с медом» – работа, которая была проведена в Северной Ирландии. Были обследованы почти 500 больных с аденокарциномой.
И оказалось, что только у 7% аденокарцинома была обнаружена в ходе динамического наблюдения за пациентами с выявленным ранним пищеводом Барретта. Остальные 90% были такие же, как пациент, о котором я говорил. Они уже пришли на стадии аденокарциномы пищевода. И это еще раз подчеркивает необходимость диспансерного наблюдения больных, особенно с эрозивными формами рефлюкс-эзофагита, дабы предотвратить развитие пищевода Барретта, а затем наблюдать таких больных.
В заключение я могу сказать, что наличие пищевода Барретта следует исключать у любого больного с длительным течением гастроэзофагеальной рефлюксной болезни. Риск развития аденокарциномы оказывается наиболее высоким у больных с длинным сегментом пищевода Барретта и дисплазией высокой степени. Тактика ведения таких пациентов зависит от наличия или отсутствия дисплазии эпителия и ее степени и предполагает динамическое диспансерное наблюдение, проведение повторных эндоскопических исследований с биопсией, длительный прием ингибиторов протонной помпы в виде монотерапии или в комбинации с другими методами лечения.
Источник: internist.ru
Синдром Барретта
Синдром Барретта – патология пищевода, характеризующаяся желудочной метаплазией эпителия, обусловленная хроническим гастроэзофагеальным рефлюксом и воздействием соляной кислоты на слизистую оболочку. Является предраковым состоянием. Клинически проявляется отрыжкой, изжогой, болью за грудиной и признаками рефлюкс-эзофагита. Золотым стандартом диагностики считают эзофагогастроскопию с биопсией, дополнительно назначают хромоскопию, манометрию и рН-метрию пищевода, контрастное рентгенологическое исследование (эзофагографию). Лечение консервативное (антисекреторные и антацидные препараты, прокинетики), при осложненном течении — хирургическое.
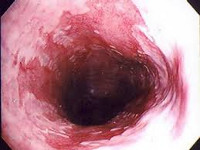
Общие сведения
Синдром Барретта, также известный под названием пищевод Барретта – тяжелое заболевание, возникающее вследствие длительного регулярного воздействия кислого желудочного сока на проксимальные отделы пищевода при гастроэзофагеальной рефлюксной болезни. Основная опасность данной патологии связана с частым развитием аденокарциномы пищевода на фоне метаплазии эзофагеального эпителия. Впервые метапластический эпителий пищевода был описан Барретом еще в 1950 году, однако рассматривался автором как вариант нормы (смещение желудка в грудную полость при врожденном укорочении пищевода). Семь лет исследований в гастроэнтерологии понадобились Барретту для установления того факта, что метаплазированный эпителий, содержащий бокаловидные клетки, является патологическим предраковым состоянием.
На сегодняшний день известно, что пищевод Барретта развивается, по разным данным, у 1-80% пациентов с ГЭРБ, причем заболеваемость имеет прямую зависимость от возраста и длительности рефлюксного анамнеза. Чаще всего заболевание возникает в возрасте от 45 до 65 лет, мужчины болеют в два-пять раз чаще женщин; при малигнизации пищевода Барретта соотношение мужчин и женщин 9:1.

Причины синдрома Барретта
Главным этиологическим фактором синдрома Барретта является ГЭРБ. При этом заболевании происходит постоянный заброс кислого желудочного содержимого в нижние отделы пищевода, что в результате приводит к повреждению эзофагеального эпителия и его метаплазии. При этом в пищеводе могут выявлять кишечные, фундальные и кардиальные железы.
Наиболее вероятно перерождение клеток слизистой оболочки у пациентов с релаксацией кардиального сфинктера, повышенной кислотностью желудочного сока, угнетением секреции фактора роста эпидермиса, сбоями пролиферации эпителия. Рак пищевода у пациентов с синдромом Барретта встречается практически в 100 раз чаще, чем в общей популяции. Субстратом для образования раковых клеток является метаплазия эпителия высокой степени – для ее формирования требуется около четырех лет, а для перерождения метаплазированных клеток в раковые обычно достаточно 6-20 месяцев.
Чаще всего к возникновению пищевода Барретта у пациентов с ГЭРБ приводит ухудшение условий проживания, курение и употребление алкоголя в любых количествах, прием некоторых медикаментов на фоне рефлюкс-эзофагита. К факторам риска относят мужской пол, рефлюксный анамнез более 5 лет, возраст старше 50 лет, неоднократные рецидивы рефлюкс-эзофагита в течение года. При попадании в пищевод панкреатических ферментов и желчи заболевание протекает тяжелее, а метаплазия прогрессирует быстрее. На начальных этапах синдрома Барретта миграция цилиндрического желудочного эпителия в пищевод является защитной реакцией, т. к. такая слизистая меньше подвержена агрессивному воздействию кислой среды.
В норме цилиндрический эпителий может мигрировать за пределы Z-линии (граница между пищеводом и желудком) в рамках 2 см, а вот обнаружение метаплазии проксимальнее 2,5 см от кардиального сфинктера после нескольких биопсий позволяет констатировать наличие у пациента синдрома Барретта.
Симптомы пищевода Барретта
Сложность диагностики синдрома Барретта заключается в том, что его клинические признаки полностью обусловлены гастроэзофагеальной рефлюксной болезнью, а выявить заболевание возможно только после биопсии эпителия. Наиболее частой жалобой (ее предъявляют три четверти пациентов) является изжога, возникающая из-за длительного воздействия кислой среды желудка на слизистую оболочку пищевода. Изжога чаще беспокоит после еды, физических нагрузок, наклонов туловища. Схожий патогенез имеет и возникновение отрыжки кислотой, желчью или воздухом. Регургитация пищевых масс из желудка в ротовую полость развивается из-за выраженной релаксации кардиального сфинктера, который не способен больше удерживать содержимое в полости желудка.
Гораздо реже больного может беспокоить дисфагия: обычно она развивается при выраженной метаплазии, а ее усиление, сопровождающееся рвотой и кровотечениями, может указывать на наличие аденокарциномы пищевода. Синдром Барретта часто связан с явлениями эрозивного эзофагита, которому сопутствуют хронические кровотечения, анемия, исхудание. Кроме того, такие симптомы, как дисфагия, кровотечения, анемия и кахексия обычно указывают на рак пищевода.
Диагностика синдрома Барретта
При появлении первых признаков ГЭРБ необходимо обратиться к гастроэнтерологу. Золотым стандартом диагностики рефлюкс-эзофагита является эзофагогастроскопия с эндоскопической биопсией очагов измененного эпителия.
Во время эзофагоскопии метаплазированные участки слизистой оболочки визуализируются в виде языков гиперемии, распространяющихся от Z-линии в проксимальном направлении более чем на 2,5 сантиметра. Для точной диагностики необходимо осуществить биопсию из четырех патологических участков, провести хромоскопию пищевода и желудка. Для дифференциации патологии и выявления осложнений также выполняют рентгенографию пищевода, гастрокардиомониторинг, импедансометрию ЖКТ, эзофагеальную манометрию, внутрипищеводную рН-метрию. Анализ кала на скрытую кровь позволяет выявить внутреннее кровотечение из верхних отделов пищеварительной трубки.
Морфологическое исследование биоптатов при синдроме Барретта обычно выявляет элементы желудочного эпителия в слизистой оболочке пищевода (цилиндрические эпителиальные клетки, фундальные, кардиальные и кишечные железы). Учитывая наследственную предрасположенность к синдрому Барретта и аденокарциноме пищевода, рекомендуется исследование уровня маркеров дисплазии пищевода в крови.
Отсутствие признаков метаплазии эпителия в биоптатах не позволяет исключить синдром Барретта у пациента. Довольно часто биопсия пораженных участков слизистой оболочки затруднена усиленной перистальтикой пищевода, рефлюксом желудочного содержимого, мелкоочаговым и рассеянным расположением патологических зон. Таким пациентам рекомендуют проводить динамические консультации эндоскописта с повторными биопсиями пищевода.
Лечение синдрома Барретта
На сегодняшний день оптимальные методы лечения синдрома Барретта, позволяющие добиться полного регресса клинических проявлений и гистологических изменений, находятся в стадии разработки.
Терапевтическая тактика при синдроме Барретта зависит от стадии заболевания и выраженности симптомов. При легкой и умеренной метаплазии эпителия лечение заключается в ликвидации клинических проявлений гастроэзофагеального рефлюкса, восстановлении нормального эпителиального покрова пищевода, предупреждении злокачественного перерождения.
Для лечения ГЭРБ используют немедикаментозные средства и лекарственные препараты. К немедикаментозным методам воздействия относят нормализацию режима дня и питания, лечение ожирения, сон в полусидячем положении, отказ от вредных привычек, тугих ремней, избыточных физических нагрузок.
Медикаментозная терапия включает антисекреторные препараты (блокаторы протонной помпы, при их непереносимости – блокаторы Н2-гистаминовых рецепторов); антациды; прокинетики (метоклопрамид, домперидон). Наибольший эффект медикаментозного лечения достигается при комбинации трех этих групп препаратов. Если отмечается заброс желчи в пищевод, назначают урсодезоксихолевую кислоту. При наличии жалоб на чувство распирания и переполнения желудка после еды применяются ферментные препараты, не содержащие в своем составе желчные кислоты.
Исследования в области гастроэнтерологии показывают, что у пациентов, длительно получавших антисекреторные и антацидные препараты до выявления данного заболевания, сегмент пищевода Барретта значительно короче, а уровень метаплазии достоверно ниже, чем у больных, не использовавших указанные медикаменты.
Показаниями к оперативному лечению синдрома Барретта считают стриктуры пищевода, высокую степень метаплазии, резистентную к терапии язву пищевода, кровотечения из пищевода, высокий риск малигнизации. Для разрушения метаплазированного эпителия применяются эндоскопические методики: фотодинамическая, лазерная, плазменная аргонная терапия; электрокоагуляция и криодеструкция; эндоскопическая резекция слизистой оболочки пищевода.
Прогноз и профилактика синдрома Барретта
Прогноз при выявлении синдрома Барретта неблагоприятный. У пациентов с длинным сегментом метаплазированного пищевода эзофагеальный рак диагностируется в 0,5-1% случаев, при коротком сегменте метаплазии частота малигнизации значительно ниже. При коротком сегменте синдрома Барретта и низкой степени метаплазии возможен полный регресс эндоскопической картины на фоне консервативного лечения у 8% пациентов. Проведение антирефлюксной операции приводит к выздоровлению примерно у 4% больных.
Предупредить развитие синдрома Барретта возможно только путем своевременной диагностики и лечения гастроэзофагеальной рефлюксной болезни. Специфическая профилактика пищевода Барретта не разработана. Пациенты с синдромом Барретта, даже после эффективного консервативного и хирургического лечения, требуют ежегодного эндоскопического обследования с биопсией эпителия.
Источник: www.krasotaimedicina.ru
Болезнь пищевод Барретта: причины и лечение

Пищеводом Баррета называется изменение клеток слизистой оболочки этого органа. Развиваться болезнь может на любом участке пищевода, но чаще поражает кардиальный (нижний) отдел. Патология является осложнением других нарушений работы желудочно-кишечного тракта и прогрессирует достаточно медленно. Но все же это серьезный диагноз, грозящий развитием рака, поэтому пищевод Барретта нельзя оставлять без лечения. Как определить патологию, каковы причины развития болезни и что может сделать человек, чтобы облегчить свое состояние, разбирался MedAboutMe.
Как развивается болезнь пищевод Барретта

Изжога — частая жалоба пациентов с гастроэнтерологическими диагнозами. Чаще всего она говорит о том, что содержимое желудка плохо удерживается, развивается рефлюкс — обратный ход жидкостей и кусочков пищи. Желудочный сок попадает в пищевод, где приводит к воспалению, ожогу и неприятным симптомам жжения. Именно у таких пациентов встречается такое тяжелое осложнение, как пищевод Барретта.
Эта болезнь диагностируется в том случае, если обнаружена метаплазия — замещение клеток слизистой пищевода клетками, характерными для стенок желудка. При диагностике в этом участке вместо плоского эпителия обнаруживается цилиндрический.
Метаплазия развивается крайне медленно, чаще всего обнаруживается у пациентов старше 40 лет после длительных жалоб на нарушения пищеварения. Однако сама по себе она представляет серьезную опасность, поскольку измененные участки склонны к малигнизации — пищевод Барретта считается предраковым состоянием. Такая патология предшествует аденокарциноме — агрессивному виду рака. В отличие от метаплазии Барретта, для этой болезни характерно стремительное развитие: пятилетняя выживаемость составляет не более 15%.
Причины болезни: рефлюкс, язва желудка и другое
Как уже говорилось, пищевод Барретта не возникает сам по себе. Это осложнение других патологических процессов, связанных с нарушениями работы желудка. Основной причиной является гастроэзофагеальная рефлюксная болезнь (ГЭРБ), при которой нижний пищеводный сфинктер ослабевает и содержимое желудка выбрасывается назад. Желудочный сок приводит к хроническому повреждению слизистой и, как следствие, к метаплазии клеток.
ГЭРБ — наиболее распространенная, но не единственная причина развития патологии. Так, к перерождению эпителия могут приводить следующие болезни:
- Гастрит с повышенной кислотностью, особенно при наличии бактерии Helicobacter pylori. .
- Осложнения после хирургического лечения желудка.
- Дуоденогастральная рефлюксная болезнь.
Кроме этого, риск развития пищевода Барретта существенно повышается под действием следующих факторов:
- Предрасположенность к онкологии (в семье были случаи такого заболевания).
- Несоблюдение диеты — обилие острой и жареной пищи, мучных блюд, нерегулярное питание.
- Ожирение по абдоминальному типу, когда жир накапливается на животе и сдавливает внутренние органы.
- Частое употребление алкоголя.
- Курение.
- Сахарный диабет.
- Длительный прием некоторых лекарств, например анальгетиков.
Симптомы: изжога, першение в горле и прочее
Специфических симптомов у метаплазии Барретта нет — перерождение клеток происходит незаметно для пациента. При этом патология всегда возникает на фоне других заболеваний пищеварительной системы, и вот они будут сопровождаться характерными признаками. Среди наиболее частых жалоб в этом случае следующие:
- Изжога.
- Нарушение процесса глотания (дисфагия).
- Отрыжка.
- Периодическая тошнота.
- Однократная рвота после еды, особенно если речь идет о соленых или острых продуктах. , покашливание.
- Боли в животе.
- Развитие чувствительности зубов вследствие истончения эмали.
Такие симптомы говорят о том, что стенки пищевода страдают от хронического повреждения. Это еще не говорит о метаплазии, но все же является фактором риска по ее развитию. Поэтому при частой изжоге, отрыжке, тошноте и других нарушениях пищеварения нужно обязательно обратиться к гастроэнтерологу.
Диагностика и лечение пищевода Барретта
При характерных жалобах врач направит пациента на эзофагогастродуоденоскопию — эндоскопическое обследование пищевода, желудка и двенадцатиперстной кишки. С помощью этого метода гастроэнтеролог может оценить состояние стенок органов, выявить на них воспаление или другую патологию. Это базовая диагностика, которая дает возможность не только найти пораженные участки, но и установить причину их появления, например, обнаружить язву.
Подтвердить болезнь с помощью только эндоскопического обследования нельзя. Для этого необходимо проведение биопсии, которая при необходимости делается во время эзофагогастродуоденоскопии. Если в исследуемых тканях обнаружен цилиндрический эпителий, пациенту назначается лечение метаплазии.
Основная терапия направлена на лечение заболевания, вызвавшего повреждения пищевода. Кроме этого, пациенту рекомендуется соблюдение диеты и изменение образа жизни. Чтобы контролировать прогрессирование метаплазии, человек должен раз в 2-3 года проходить эндоскопическое обследование. При этом, если заболевание прогрессирует — диагностика рекомендуется каждые 6 месяцев.
В том случае если медикаментозное лечение основной болезни не дает нужного результата, зона поражения увеличивается или клетки продолжают перерождаться, назначается операция. Сегодня все чаще используются эндоскопические малоинвазивные методы — лазерная или фотодинамическая терапия, при которых разрушаются пораженные клетки. В тяжелых случаях требуется полноценная операция по удалению части пищевода.
Соблюдение диеты и другая профилактика при пищеводе Барретта
Основная задача консервативного лечения — приостановить развитие патологии. И ключевую роль в этом вопросе играет устранение повреждающего фактора, то есть уменьшение или полное устранение рефлюкса. Наряду с медикаментозной терапией ГЭРБ, гастрита или язвы потребуется соблюдение диеты и правил питания. Пациентам рекомендуется убрать из рациона следующие продукты:
- Жареное жирное мясо.
- Острую пищу, соления.
- Кондитерский крем.
- Кофе, крепкий чай.
- Кислые овощи, фрукты и ягоды. В том числе и в виде соков.
- Сливки, кисломолочные продукты с высоким процентом жирности.
- Алкоголь.
Уменьшить рефлюкс помогут и следующие правила:
- Не переедать.
- После еды минимум 20 минут посидеть, отказаться от физической нагрузки.
- Не есть на ходу, тщательно пережевывать пищу.
- Спать на высокой подушке.
- Не носить сдавливающую одежду.

О запорах не принято говорить в открытую. После прохождения данного теста вы узнаете, насколько хорошо функционирует ваш ЖКТ, и получите рекомендации по улучшению пищеварения.
Источник: medaboutme.ru