Молекулы относительно простых соединений имеют размеры меньше одного нанометра. Однако в разряд нанообъектов попадают и биологические макромолекулы, такие как белки и нуклеиновые кислоты, а также еще более крупные молекулярные «клеточные машины» и даже самые «простые» живые организмы – вирусы. Фундаментальными исследованиями этих объектов традиционно занималась и занимается молекулярная биология. Наряду с этим ученые работали над проблемами синтеза природных макромолекул, создания и применения их искусственных аналогов с новыми свойствами, причем делали это задолго до того, как нанотехнологии были объявлены государственным приоритетом
В нанодавние времена в наностране люди строили дома из нанокирпичей,
которые валялись в информационном поле. Нанофольклор
Нанотехнологии – современный подход к использованию таких свойств вещества, которые определяются его структурными элементами нанометровых размеров. Последнее означает, что при переходе вещества из макро- и микро- в наносостояние может происходить резкое, скачкообразное изменение его характеристик: физических, химических и биологических. Нанотехнология, а точнее, ее «теоретическая» ветвь, нанонаука (nanoscience), как раз и занимается изучением причин появления у вещества подобных квантовых свойств.
ДНК — Что это такое?
В практической области существование феномена «нановещества» позволяет разрабатывать технологии направленного изменения свойств материалов за счет их специфического структурирования на наноуровне. Продуктом нанотехнологий становятся необычные по свойствам материалы; ультрамалые замысловатые пространственные структуры; невидимые глазу совершенные механизмы, способные выполнять только им посильные операции на микроскопическом уровне.
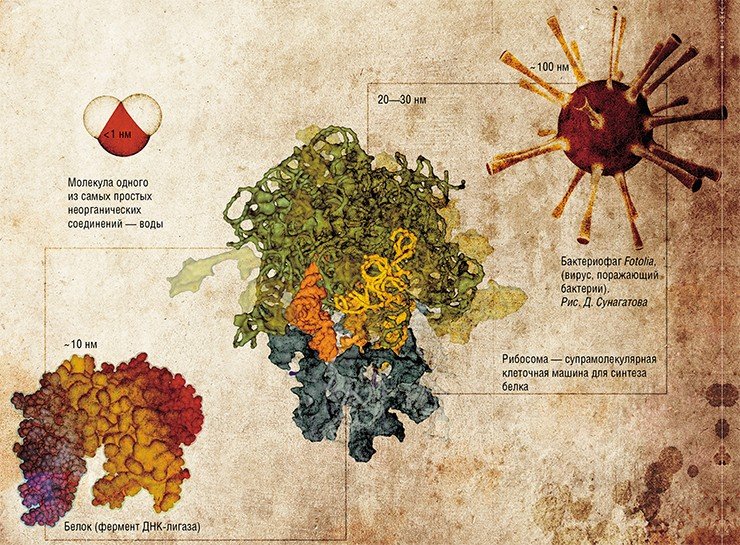
Один нанометр (одна милионная часть миллиметра) соответствует величине несложной молекулы, а наиболее простые соединения, такие как вода, имеют значительно меньший размер. Основными деталями бионанотехнологического конструктора являются значительно более крупные органические молекулы, а также супрамолекулярные комплексы – сложно организованные надмолекулярные структуры. Их размер составляет от нескольких нанометров до десятков и сотен.
В природе сложные органические молекулы и надмолекулярные комплексы образуются по принципу самоорганизации из более простых молекул. Бионанотехнология стремится установить принципы взаимодействия таких структур, чтобы воспроизвести природный процесс самосборки в искусственной системе. Это позволяет не только «синтезировать» в пробирке разнообразные биологические структуры (от единичного фермента ДНК-лигазы до рибосомы или вирусоподобной частицы), но и шагнуть дальше, создавая биологические микрообъекты с заданными свойствами, которых в природе не существует
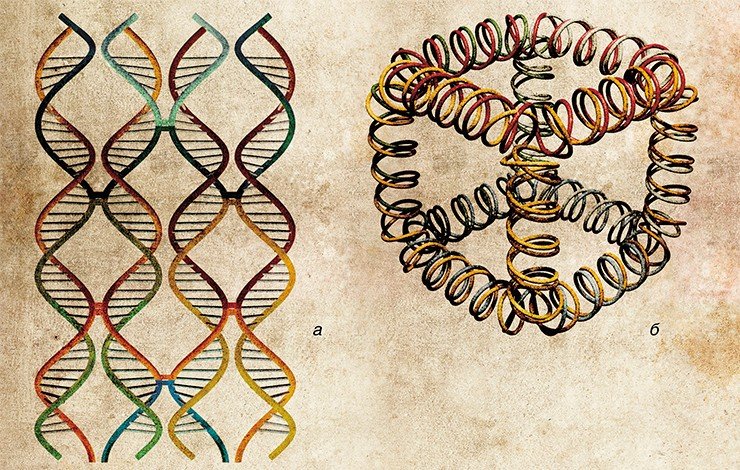
Роль главных структурных элементов в бионаноконструировании отводится молекулам нуклеиновых кислот – ДНК и РНК. Дело в том, что эти биополимеры обладают удивительной способностью самоорганизовываться в характерные пространственные конструкции – двуцепочечные структуры, удерживаемые комплементарными взаимодействиями. Это позволяет использовать нуклеиновые кислоты не только в качестве носителя генетической информации (записанной в последовательности биополимера четырьмя «буквами»-нуклеотидами), но и как удобные строительные блоки при создании наноконструкций.
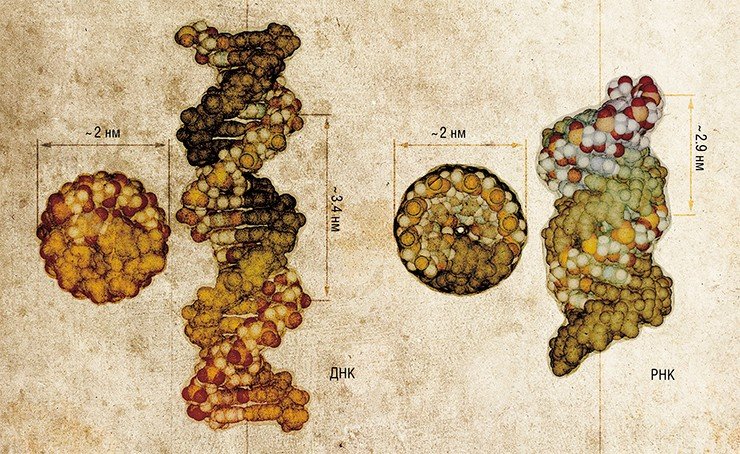
Сегодня нуклеиновые кислоты являются доступным материалом благодаря разработке эффективных методов синтеза. Так, с помощью специальных приборов – синтезаторов можно в автоматическом режиме производить нуклеотидные цепи длиной до сотни звеньев. Поскольку «ассортимент» таких молекул ограничен лишь изобретательностью самого наноконструктора, сфера применения нуклеиновых кислот благодаря их доступности и практичности быстро расширяется.
От покрытий до моторов
Самым простым примером самоорганизованной сборки наноструктур из нуклеиновых кислот является формирование ДНК-конкатемеров – полимерных структур из блоков, образованных лишь парой олигонуклеотидов (фрагментов ДНК). С помощью подобного подхода можно сконструировать также дву- и трехмерные структуры. При создании плоских и объемных конструкций наряду с «простыми» олигонуклеотидами используются также их конъюгаты (от лат. conjugatio – соединение) с другими нанообъектами неорганической или органической природы, например, с молекулами белка.
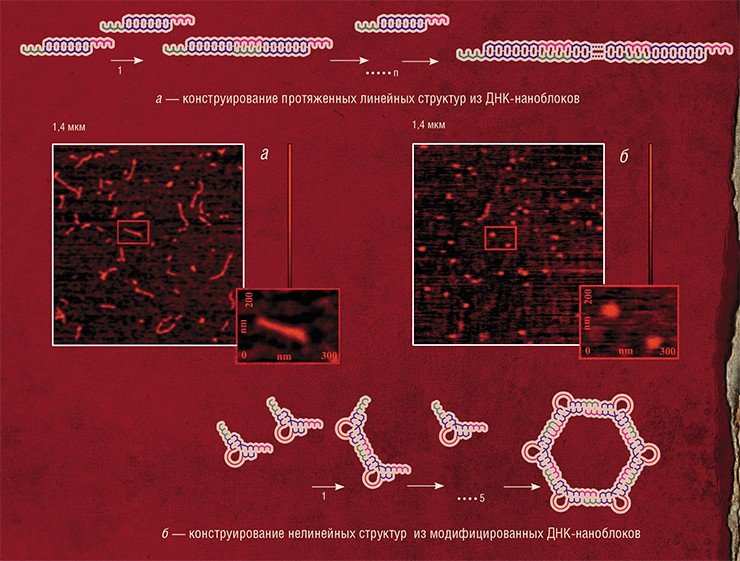
В том числе можно получить упорядоченные пленочные структуры, где неорганические наночастицы выступают в качестве узлов-разветвителей. Такие материалы рассматриваются в качестве перспективных самособирающихся покрытий-шаблонов для полупроводниковых структур при создании современных микросхем. А объемные наноконструкции могут служить в качестве уникальных биосовместимых контейнеров для упаковки фармакологических препаратов и их адресной доставки к органам-мишеням.

Еще одним примером новых материалов служат конъюгаты олигонуклеотидов с квантовыми точками – полупроводниковыми наночастицами, способными к флуоресценции в видимом диапазоне света. Наборы олигонуклеотидных зондов, меченных с помощью такой технологии, упрощают решение ряда биологических задач (например, параллельного отслеживания нескольких процессов в живой клетке), а также используются в области медицинской ДНК-диагностики и компьютерной томографии.
На основе нуклеиновых кислот можно создавать и так называемые клеточные молекулярные машины, или бионанодвигатели, – наноустройста, способные автономно совершать движения, трансформируя энергию химических реакций в механическую работу. Важной характеристикой молекулярных наномашин является их автономность или самоуправление. Наномоторы имеют множество потенциальных применений, таких как обработка информации и регуляция химических реакций, а также молекулярная сборка в различных наноэлектронных приборах и биосенсорах.
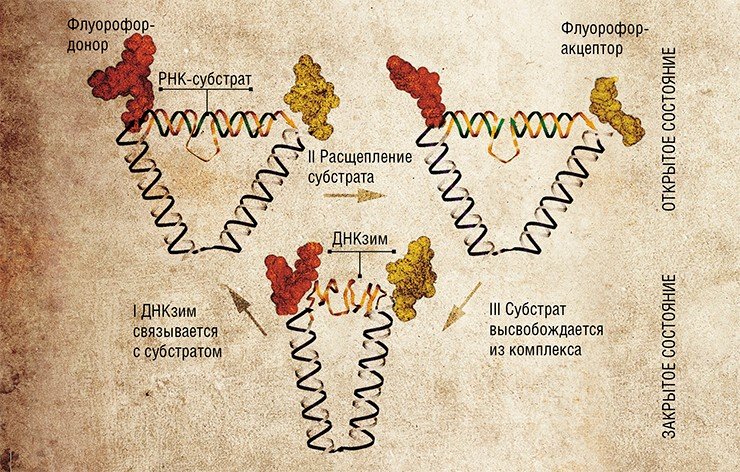
В 2004 г. созданы ДНК-наномоторы, действующим началом которых является ДНКзим «10-23» – своеобразный фермент на основе ДНК. Эти «двигатели» способны производить механические движения до тех пор, пока доступно «топливо» – РНК-субстрат. Хотя эти наноустройства вполне автономны, есть возможность регулировать их работу «извне», например, добавляя или убирая субстрат-топливо (по аналогии с автомобильным «поддаванием» или «сбрасыванием» газа). Более того, наномотор можно остановить и потом запустить вновь – для этих целей служат специально сконструированные олигонуклеотидные цепочки «тормоз» и «удаление».
Современные возможности в области компьютерного моделирования и синтеза компонентов нуклеиновых кислот практически неограничены, что позволяет уже сейчас «строить» разнообразные причудливые супрамолекулярные фигуры, форма и предназначение которых ограничиваются лишь фантазией (Aldaye, Palmer, Sleiman, 2008)
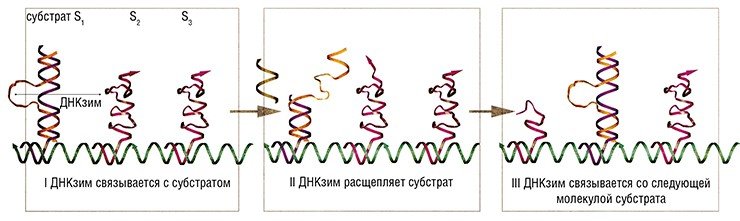
В 2005 г. сконструирован более сложный нанодвигатель, управляемый ДНКзимом «10-23», способный автономно перемещаться по определенной траектории, заданной олигонуклеотидной цепочкой. Подобные системы в будущем могут использоваться для транспортировки молекул-«грузов».
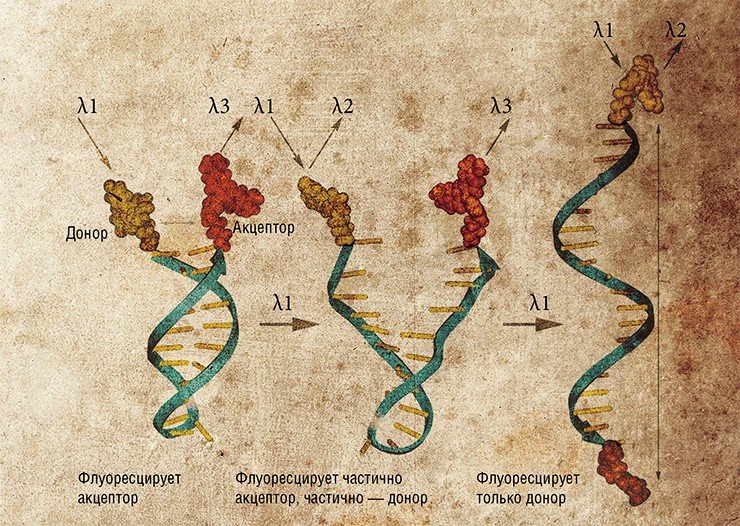
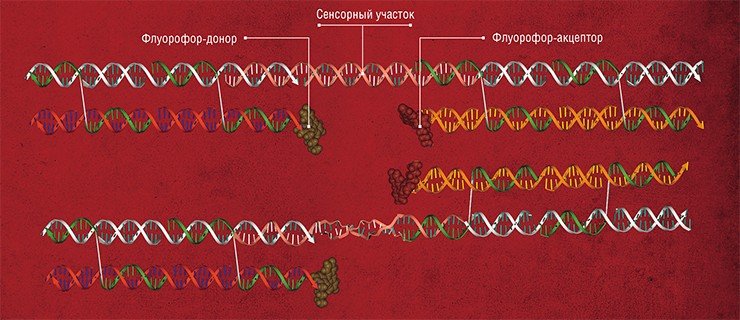
Молекулы нуклеиновых кислот служат потенциальной основой для создания еще ряда устройств и соединений. В так называемых нанопереключателях используется способность двуцепочечной спирали нуклеиновых кислот менять свою конформацию под воздействием внешних факторов, например, при связывании со специфическими веществами-лигандами. Если такой чувствительный участок соединяет два элемента наноконструкции, то при добавлении лиганда конструкция перестраивается. Таким способом можно, например, менять уровень флуоресценции нанообъекта.
Рассматривая различные наноустройства, нельзя не упомянуть об аптамерах – уникальных молекулах, сконструированных на основе нуклеиновых кислот. Аптамер представляет собой трехмерную структуру-«ключ», специфично подходящую к «замку» – определенной молекуле-мишени. В результате их взаимодействия образуются прочные стабильные надмолекулярные комплексы. Благодаря этому можно обнаружить молекулы веществ даже в сверхмалых концентрациях. Аптамеры являются важными деталями бионаноконструктора, которые используются при разработке различных супрамолекулярных устройств, в том числе биосенсоров.
Диагностируем мутации
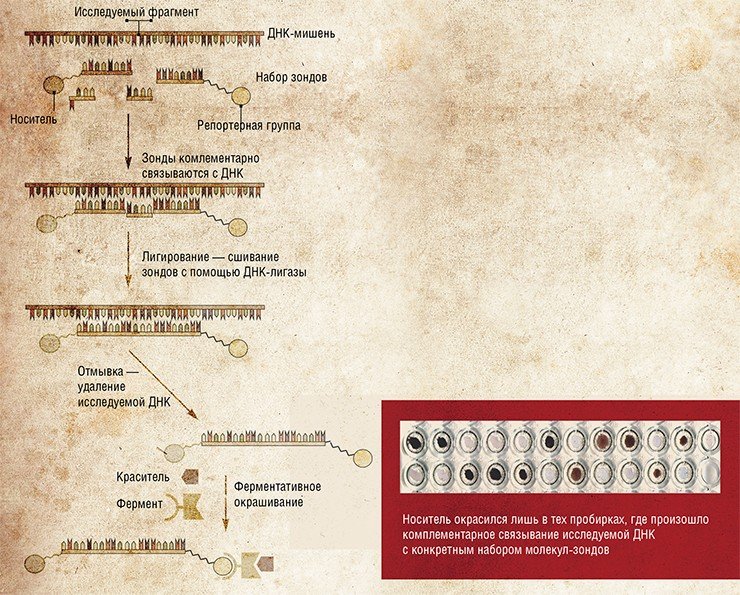
В то время как одни достижения бионанотехнологии пока следует рассматривать лишь как некие прототипы устройств отдаленного будущего (так, сегодня вряд ли можно найти достойную работу наномотору), другие незамедлительным образом внедряются в важнейшие прикладные области, в частности, в медицинскую диагностику. В их числе – диагностические сенсоры на основе нуклеиновых кислот, часть которых разрабатывалась в последние полтора десятилетия в ИХБФМ СО РАН (Новосибирск). Назначение подобных конструкций – распознавать с высокой точностью целевые последовательности ДНК благодаря специфическому связыванию нанозондов с ДНК-мишенями.
Диагностические системы, предлагаемые новосибирскими биохимиками, представляют собой своего рода кассеты из наборов коротких синтетических фрагментов ДНК. Последние способны связываться с исследуемой ДНК, формируя так называемые тандемные комплексы.

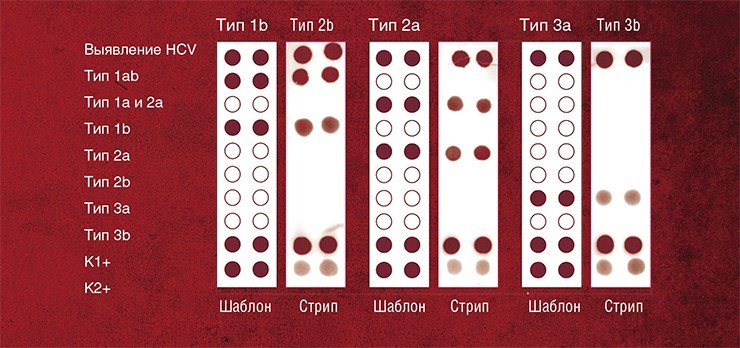
Разработанные в ИХБФМ СО РАН способы анализа структуры ДНК с использованием составных олигонуклеотидных конструкций в качестве специфических зондов признаны патентноспособными. На их основе уже разработаны тест-системы для выявления полиморфизма в различных локусах Y-хромосомы человека, точечной мутации в гене фенилаланингидроксилазы, а также для генотипирования различных вирусов
В результате фундаментальных исследований этих комплексов удалось создать на их основе тест-системы для выявления точечных мутаций в ДНК. А ведь подобные мутации нередко являются причиной серьезных наследственных заболеваний, а также определяют патогенность различных штаммов микроорганизмов и вирусов.
Кроме того, с помощью этих тест-систем можно выявить и другие локальные нарушения в ДНК-последовательностях, такие как потеря сегмента ДНК, олигонуклеотидные замены и т. п.
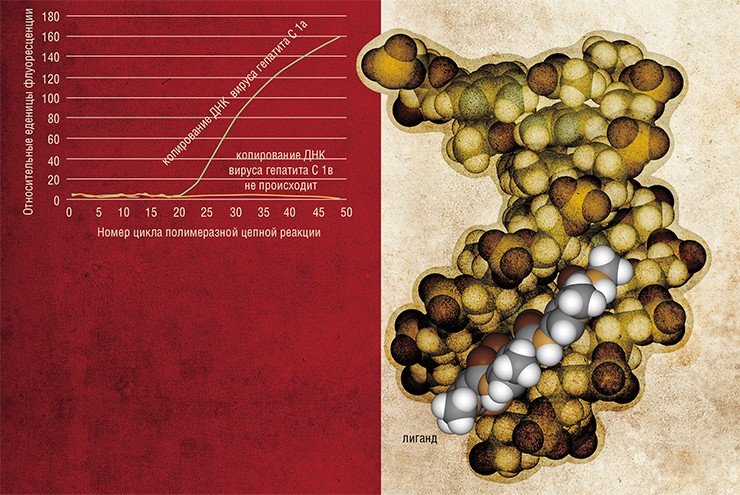
Еще одно перспективное направление использования материалов из арсенала бионанотехнологии в медицинской диагностики — создание новых типов нанозондов для современных методов количественного анализа ДНК, таких как метод «ПЦР в реальном времени» (Real-time PCR). Этот метод используется для детекции и одновременного определения количества молекул ДНК-мишени в образце.
Транспорт для лекарства
Важнейшая проблема в клинической практике – адресная доставка в клетки-мишени биологически активных макромолекул, таких как «терапевтические гены» . Чтобы решить ее, необходимо обеспечить защиту этих препаратов во время транспорта и концентрирование их в определенных клетках.
Одно из основных препятствий для использования препаратов на оcнове нуклеиновых кислот – низкая эффективность их проникновения внутрь клеток, трансфекции. Проблема трансфекции обусловлена тем, что млекопитающие обладают рядом механизмов, препятствующих проникновению в них чужеродных молекул ДНК и РНК – генетического материала потенциально болезнетворных агентов (вирусов, бактерий и т. п.)
Вдобавок самим клеткам трудно захватывать нуклеиновые кислоты, находящиеся в свободном («раздетом», как говорят специалисты) состоянии, из-за наличия своеобразного электростатического барьера. Дело в том, что клеточная мембрана и сахарофосфатный остов молекул нуклеиновых кислот обладают одноименным – отрицательным – зарядом, вследствие чего между ними возникает электростатическое отталкивание.
Транспорт в клетку протяженных нуклеиновых кислот осложняется еще и их относительно большим размером, жесткой пространственной структурой и невысокой подвижностью в биологических жидкостях и цитоплазме клеток.
Методы трансфекции постоянно совершенствуются на протяжении уже более трех десятилетий. Наиболее современные из них основаны на использовании хитроумных конструкций на основе нанокомплексов нуклеиновых кислот и их конъюгатов с органическими лигандами или наночастицами.
Зримые различия
На основе олигонуклеотидных зондов разработан точный и высокоэффективный метод «ПЦР в реальном времени» (Real-Time PCR), позволяющий не только детектировать ДНК-мишень, но и определять точное количество молекул этой мишени.
Суть обычной полимеразной цепной реакции (ПЦР) состоит в том, что на основе нуклеотидной последовательности первичной ДНК-матрицы с помощью фермента ДНК-полимеразы синтезируются цепи ДНК, служащие матрицами в следующем цикле копирования. В результате можно получить неограниченное число копий первичной ДНК. Метод «ПЦР в реальном времени» отличается тем, что позволяет определять количество ДНК по мере ее накопления в реакции.
Наиболее перспективным является подход, основанный на использовании TaqMan-зондов.
Они представляют собой олигонуклеотиды с флуоресцентной меткой на одном конце и «тушителем» флуоресценции – на другом, который поглощает излучение от флуоресцентной метки, делая его незаметным для систем детекции.
ДНК-полимераза обладает способностью разрушать фрагменты двухцепочечной структуры, встречающиеся ей по ходу синтеза второй цепи на матрице одноцепочечной ДНК. Та же участь постигает и TaqMan-зонды, которые комплементарно присоединяются к определенному участку ДНК-мишени. В результате разрушения зонда флуоресцентная метка отделяется от тушителя, что приводит к появлению регистрируемой флуоресценции.
Недостатком метода является его низкая чувствительность для распознавания ДНК-мишеней, отличающихся друг от друга всего одной заменой нуклеотида. Для решения этой проблемы в лаборатории медицинской химии ИХБФМ СО РАН предложено использовать в качестве зондов конъюгаты коротких олигодезоксирибонуклеотидов с малобороздочными лигандами — синтетическими молекулами, прочно связывающимися с двойной спиралью ДНК
Некоторые встречающиеся в природе молекулы РНК обладают свойством формировать компактные молекулярные комплексы. Среди них φ29 – короткая (117 нуклеотидов) РНК бактериофага, участвующая в упаковке его ДНК-генома в белковую оболочку. На основе этой РНК сконструированы наночастицы так называемой «упаковочной» pRNA («packing RNA»).
Благодаря образованию водородных связей между отдельными доменами она может путем самосборки образовывать димеры, тримеры и гексамеры размерами до 10—30 нм (Shu, Huang et al., 2003; Khaled, Guo, Li et al., 2005).
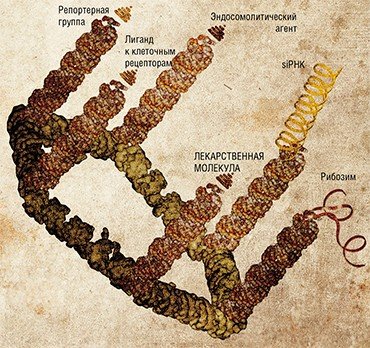
Такие комплексы pRNA служат в качестве упаковывающего каркаса для «терапевтических» молекул нуклеиновых кислот. Их удается еще дополнительно «функционализировать», как говорят биологи, – путем присоединения различных функциональных группировок задать адрес доставки и клеточное назначение. Это могут быть так называемые репортерные группы, позволяющие контролировать эффективность трансфекции; генонаправленные молекулы (рибозимы, малые siРНК), нарушающие выполнение определенных генетических клеточных программ; лиганды клеточных рецепторов и мембранных белков, определяющие адресованный захват наноконструкции клетками-мишенями.
Примером такой адресующей группировки может служить всем известный фолат (фолиевая кислота, витамин В9). Рецепторы к нему обычно отсутствуют на поверхности нормальных дифференцированных тканевых клеток, но во множестве присутствуют на поверхности клеток различных опухолей. В результате остаток фолата, присоединенный к наноконструкции, должен обеспечить ее доставку преимущественно в раковые клетки.
Эксперименты по доставке подобных pRNA-комплексов, несущих биологически активный олигонуклеотид (рибозим или интерферирующую siРНК), показали, что они эффективно проникают в опухолевые клетки, имеющие фолатные рецепторы, где и подавляют работу генов-мишеней.
Поскольку pRNA-молекула способна образовывать гексамерные комплексы, то можно увеличить ее функ-циональность путем присоединения к ней до шести различных субъединиц. В результате селективность и эффективность терапевтической наноконструкции могут значительно возрасти.
Самосборка наночастиц на основе pRNA является контролируемым процессом, что дает возможность определять их размер путем манипуляции со структурными доменами. Димеры и тримеры pRNA образуют частицы размером 20—40 нм. Подобные структуры достаточно крупны, чтобы исключить их быстрое выведение из циркулирующей крови, но при этом не достигают критического (более 100 нм) размера, когда проникновение комплексов в клетки затрудняется.
Холестериновый посыльный
Другой подход к решению проблемы доставки терапевтических нуклеотидных последовательностей в клетку состоит в повышении эффективности их естественного транспорта через клеточную мембрану. Этот подход основан на формировании различных супрамолекулярных структур.
В частности, протяженные олигонуклеотидные нанокомплексы, созданные в ИХБФМ СОРАН, активнее проникают в клетки разного тканевого происхождения из-за своего повышенного сродства к фосфолипидным мембранам клеток.
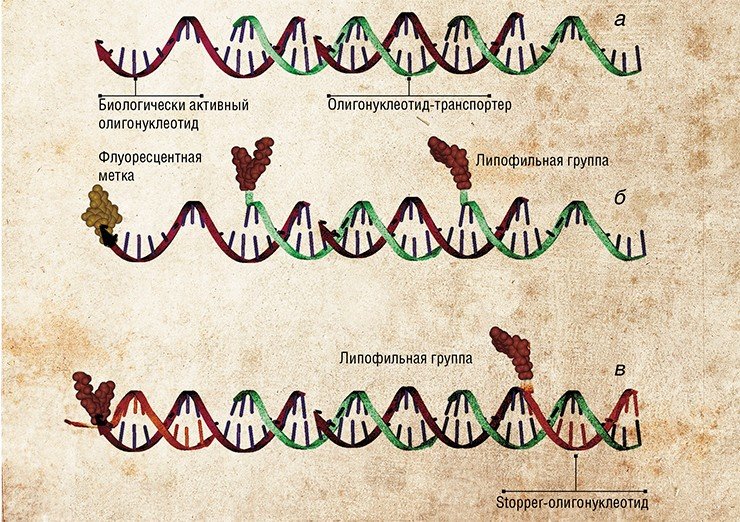
Эти наноконструкции представляют собой конкатамерные комплексы, т. е. длинные двуцепочечные молекулы ДНК с перекрывающимися комплементарными нуклеотидными последовательностями. Одна из цепей представляет собой биологически активную молекулу, которую надо доставить в клетку (адресная молекула); другая цепь – молекулу-транспортер (Gusachenko et al., 2008).
Проблема адресной доставки лекарства к органам- и клеткам-мишеням – одна из центральных в современной медицине. Бионанотехнологи создают на основе нуклеиновых кислот конструкции, способные нести сразу несколько функциональных групп, благодаря которым они успешно преодолевают барьеры на пути транспорта биологически активных молекул
В качестве функциональной группировки в состав олигонуклеотидов-транспортеров вводят липофильный остаток холестерина, который способствует транспорту конструкции в клетку благодаря сродству с фосфолипидной клеточной мембраной. Нужно отметить, что функциональные группировки при этом присоединяют к транспортеру, а не к терапевтической молекуле, что позволяет сохранить высокую биологическую активность последней.
Кооперация и интеграция специалистов и проектов – залог успеха современных бионанотехнологических исследований. Эти принципы успешно реализуются в Сибирском отделении РАН
Эта система доставки была испытана в экспериментах по транспорту так называемого антисмыслового олигонуклеотида, который вызывает выключение гена, кодирующего зеленый флуоресцирующий белок.
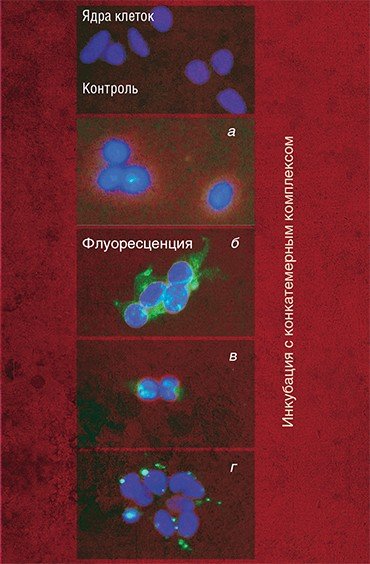
В клетках, постоянно синтезирующих этот белок и обладающих благодаря этому зеленой флуоресценцией, такой нанокомплекс вызывал снижение флуоресценции до 30 %. Это свидетельствует о том, что антисмысловой олигонуклеотид проник в клетки и специфически подавил работу гена, кодирующего флуоресцирующий белок.
Сегодня большинство разработок в области бионанотехнологии реализуется в рамках междисциплинарных проектов. Для того, чтобы добиться успеха, принципиально необходимо тесное сотрудничество исследовательских организациий различного профиля.
В связи с этим нельзя не отметить совместные разработки новосибирских биохимиков и специалистов из Института физики полупроводников СО РАН, в распоряжении которых имеются уникальные микро- и нанопористые мембраны на основе кремния. Эти материалы являются перспективными платформами как для разработки современных биосенсорных устройств и проведения ДНК-диагностических исследований, так и для ультраселективного выделения клеток-мишеней.
Другим междисциплинарным проектом является разработка микро- и нанофлюидных устройств для амплификации (умножения) и анализа нуклеиновых кислот, которая проводится совместно со специалистами Института катализа СО РАН.
Кроме того, ряд институтов Сибирского отделения, работающих в областях химии, физики и даже петрографии, готовы предоставить ценные для развития бионанотехнологии объекты: нанопорошки (наносферы, нанотрубки, квантовые точки) и наноканальные материалы.
Возможность такого сотрудничества в области материалов и технологий в рамках интеграционных проектов Сибирского отделения РАН открывает перспективу создания у нас высокотехнологичных интеллектуальных биосенсоров и «умных» лекарственных препаратов, которые будут определять лицо медицины и биотехнологии завтрашнего дня.
Aldaye F. A., Palmer A. L., Sleiman H. F. Assembling Materials with DNA as the Guide // Science. 2008. V. 321. P. 1795—1799.
Chen Y., Wang M., Mao C. An autonomous DNA nanomotor powered by a DNA enzyme // Angew. Chem. Int .Ed. Engl. 2004. V. 43.
P. 3554—3557.
Gusachenko (Simonova) O. N., Pyshnyi D. V., Vlassov V. V., Zenkova M. A. Modified concatemeric oligonucleotide complexes: new system for efficient oligonucleotide transfer into mammalian cells // Hum. Gene. Ther. 2008. V. 19.
P. 532—546.
Khaled A., Guo S., Li F., Guo P. Controllable self-assembly of nanoparticles for specific delivery of multiple therapeutic molecules to cancer cells using RNA nanotechnology // Nano Lett. 2005. V. 5. P. 1797—1808.
Shu D., Huang L. P., Hoeprich S., Guo P. Construction of phi29 DNA-packaging RNA monomers, dimers, and trimers with variable sizes and shapes as potential parts for nanodevices // J. Nanosci. Nanotechnol. 2003. V. 3. P. 295—302.
Simmel F. C., Dittmer W. U. DNA Nanodevices // Small. 2005. V. 1. N. 3. P. 284—299.
Tian Y., He Y., Chen Y. et al. DNAzyme that walks processively and autonomously along a one-dimensional track // Angew. Chem. Int. Ed. Engl. 2005. V.44.
P. 4355—4358.
Источник: scfh.ru
Из чего состоит ДНК
Из чего состоит ДНК? Кому и когда удалось найти эту молекулу в клетках людей, и прочих живых существ? В чём уникальность открытия механизма наследования и чем это обернулось для всего человечества, читайте далее в этой статье.
История
Открытие дезоксирибонуклеиновой кислоты произошло в 1869 году. И принадлежит открытие Иоганну Фридриху Мишеру. Он был биологом из Швейцарии и занимался изучением гноя. По большому счёту открытие можно назвать случайным, и сам Мишер не понял, что именно он открыл. Он назвал своё открытие нуклеином.
А позже нуклеиновой кислотой, когда у неё обнаружились кислотные свойства.
Назначение этой кислоты было загадочно и неизвестно, хотя некоторые учёные уже поднимали вопрос о наследственности и существовании механизмов наследования. Современное представление о том из чего состоит цепь ДНК, было сформировано Д. Уотсоном и Ф. Криком в 1953 году. Несколько ранее, в середине тридцатых годов советские ученые А.Р. Кезеля и А.Н.
Белозерский доказали, что ДНК встречается у всех живых видов. До их работы считалось, что эта молекула присутствует только в организме животных видов, а в растениях присутствует только РНК.
Тот факт, что дезоксирибонуклеиновая кислота является механизмом сохранения наследственной информации, был открыт только в 1944 году группой исследователей из Освальда. Так, совокупными усильями разных учёных мира была приоткрыта тайна эволюционного процесса и механизмов в его основе.
Использование в медицине
Открытие того из чего состоит молекула ДНК дало толчок к развитию множества новых услуг и направлений экспериментальной медицины. Благодаря новым технологиям, которые стали возможны вследствие исследования генома, сегодня почти любому доступны:
- Диагностика заболеваний на сверхранней стадии. Анализ позволяет выявить инфекцию, даже если заболевание находится в инкубационном периоде, и нет ни каких симптомов.
- Определение отцовства. Так же материнства и прочих родственных связей. При этом различные тесты можно проводить, как с участием потенциальных родителей, так и без них.
- Тестирование на непереносимость пищевых продуктов. Какие вещества хорошо усваиваются организмом, какие плохо или не усваиваются вовсе, что вызывает аллергические реакции – всё это расскажут результаты индивидуального исследования.
- Анализ этнической принадлежности – с какими народами перекрещивались далекие предки, и какие национальности формируют вас сегодня.
- Исследование на наличие наследственных заболеваний, в том числе и спящих, которые передаются через поколение и более.
И это только самые востребованные тесты, имеющие коммерческий интерес и полезные для простого обывателя. Если говорить о перспективах лабораторных научных исследований, то многие учёные-генетики не без энтузиазма готовятся совершить самое великое открытие за всю человеческую историю — победить болезни и саму смерть.
Строение молекулы ДНК
Дезоксирибонуклеиновая кислота состоит из двух цепочек нуклеотидов, которые объединены меж собой водородными связями и закручиваются в двойную спираль. Нуклеотиды в каждой цепи — это кирпичики, из которых складываются гены, биологическая их кодировка. Для каждого гена его место положения в цепочке и порядок нуклеотидов условно одинаков. Условно поскольку у одного гена возможны вариации, различное расположение некоторых нуклеотидов в составе гена. Но, в таком случае вместе со сменой структуры меняется и функциональность самого гена.
Путь от цепочки к хромосоме
У всех живых организмов клеточная структура и эти клетки содержат внутри себя ядро – такие клетки называются эукариоты. У бактерий и архей (древних одноклеточных организмов) такого ядра нет. Так же ядра в клетке нет у вирусов и вироидов ( инфекционных агентов, вызывающих болезни растений), но считать ли их живыми до сих пор вопрос дискуссионный.
Ядра клеток содержат в себе структуры, хранящие наследственную информацию – хромосомы. А вот сама хромосома и содержит внутри себя спиральную молекулу дезоксирибонуклеиновой кислоты, которая осуществляет функцию хранения наследственной информации.
Процесс упаковки ДНК спиралей
Спираль генов, как не казалась бы она мала, всё же очень большая для микромира. Вероятно отсюда и её спиральная форма, которая позволяет ей быть более компактной. Помимо обычной спиральности ДНК может закручиваться и в форму суперспирали. Суперспирализация – это явление, когда двойная спираль накручивается на гистоновый белок, и получается, что-то вроде биокатушки. Если закручивание в двойную спираль укорачивает цепочку генов в 5 или 6 раз, то суперспирализация доводит это сокращение до 30 раз.

Как гены связаны с ДНК
Гены это самая изученная и расшифрованная на сегодня часть ДНК. Так, каково строение генов ДНК? Фактически цепочки нуклеотидов из генов и состоят. Именно гены определяют цвет глаз, волос, форму черепа, рост, группу крови и прочие физиологические качества.
Остаётся ещё много областей генома, функциональность которых не известна. Всё, что пока о них могут сказать генетики, это то, что данные области генома не участвую (по крайней мере, напрямую) в формировании организма и его функционировании.
Хромосома: определение и описание
Считается, что хромосомы это нуклеотидные биомеханизмы, которые находятся в ядре клетки. Эти биомеханизмы являются носителями и передатчиками наследственной информации, и в свою очередь содержат в себе двойную спираль дезоксирибонуклеиновой кислоты.
Чем отличаются хромосомы друг от друга
На примере Х хромосомы, цепи нуклеотидов могут пересекаться внутри хромосомы различно:
- В перекрестии хромосомы, пересекаясь точно посередине друг друга.
- Там же, но пересекаясь не точно.
Во втором случае одни концы получившегося перекрестия будут длиннее, а другие короче. Называют такие концы длинным и коротким плечом хромосомы. Отсюда и форма Y хромосомы, у которой ярко выражены длинные плечи, а короткие настолько не велики, что схематически не указываются.
Науке известных хромосомы трёх основных форм:
- Х хромосома, которая встречается у женщин и у мужчин.
- Y хромосома, встречающаяся только у мужчин.
- В хромосома изредка встречается у растений, и считается отмирающей, поскольку редко наследуется. Обычно её наличие в растении связывают с его слабостью и болезненностью.
Всего в клетке человеческого организма находится 46 парных хромосом: 22 пары «обычных» и одна пара половых (ХХ у женщин и XY у мужчин). Интересный факт – если добавить или отнять всего одну пару хромосом, человек может стать помидором или орангутангом.
Наследственные болезни
Генетический код это очень многофункциональная и противоречивая структура. С одной стороны он должен хранить информацию в неизменном эталонном виде, и эта функция проявляется возможностью ДНК восстанавливать искусственные повреждения в следующем поколении. С другой же стороны, геном может быть либо поврежден, либо измениться сам, что называют мутацией.
Мутации естественное свойство генов, и последствия этих мутация бывают, как отрицательные, так и положительные. Хоть мутации и называют поломками, но это определение спорно. Некоторые мутации в чём-то ослабляют организм – именно эти мутации и ищут во время тестирования на непереносимость пищевых продуктов.
Такие мутации создают повышенные риски возникновения, какого либо заболевания при соблюдении некоторых факторов. Соответственно, если исключить эти факторы из своей жизни, то с ними будут исключены и вероятности возникновения заболевания.
Существуют и более сложные повреждения ДНК человека, которые вызывают врождённые наследственные заболевания. Например, одна лишняя хромосома в 21 паре вызывает у человека болезнь Дауна с самого рождения.

Расшифровка ДНК
Расшифровка ДНК клетки это большое и дорогостоящее исследование всех известных человеческих генов. А после завершения исследовательского проекта «Геном человека» это порядка 25 тысяч генов. И хоть расшифровка значительно подешевела, и за прошедший десяток лет упала со ста тысяч долларов до двух тысяч на одного человека, далеко не каждому это покажется приемлемой ценой.
Для удешевления медицинских и генетических исследований всю расшифровку генома разделили тематически. Так стали появляться различные тестирования, по этому принципу они и планируются – выборка генов отвечающих за интересующие тематику исследования процессы.
Синтез РНК
Нуклеотиды (из которых формируются гены) подразделяются на 4 образующих элемента: аденин, тимин, гуанин и цитозин, которые содержат остатки фосфора, пептозы и азотистого основания. В цепочках ДНК эти нуклеотиды располагаются параллельно друг другу строгими парами: аденин только с тимином, а гуанин только с цитозином.
Необходимо подчеркнуть, что молекула дезоксирибонуклеиновой кислоты ни целиком, ни частично не может (или не должна) покинуть пределов ядра. РНК выступает в роли копии участка цепи генома, которая способна покинуть ядро, попасть в саму клетку и воздействовать на идущие в ней процессы. И происходит это удивительным образом:
- Спираль генов раскручивается на одном из своих участков и формирует развернутые нити обоих цепочек генов.
- К развернутому участку подходит специальный фермент-строитель и поверх этого участка синтезирует копию.
- У копии есть одно ключевое отличие от оригинальной структуры нуклеотидов: тимин во всех парах ней заменён на урацил. Это и позволяет ей покидать пространство ядра клетки.
Синтез белка при помощи генов
Основное взаимодействие, которое происходит между генами и клеткой заключается в том, что разные гены могут заставлять клетку синтезировать различные белки с самыми неожиданными свойствами. Так группа генов участвующих в процессе старения клетки может, как заставить её стареть быстрее, так и омолаживаться. То есть, генов не только много, каждый из них может спровоцировать синтез нескольких видов белка.
Источник: mygenetics.ru
ДНК – строительный материал будущего

Молекула ДНК не только несет генетическую информацию, но и может быть отличным сырьем для создания элементов микроскопического конструктора. Технология, разработанная физиками из Великобритании и Нидерландов, позволяет в огромных количествах производить из молекул ДНК крошечные пирамидки, которые могут служить элементами более сложных конструкций.
В прошлом году уже сообщалось о создания наноконструкций — кубиков и октаэдров — из молекул ДНК. Однако процесс их производства был очень сложным и давал низкий выход нужных конструкций. Новый метод, разработанный физиками из Оксфордского университета и Свободного университета Амстердама, позволяет создавать триллионы нанокирпичиков за считанные минуты, сообщает журнал Science.
Рецепт их приготовления чрезвычайно прост: в соленую воду засыпать в равных пропорциях четыре типа одноцепочечных фрагментов ДНК. Смесь нагреть почти до точки кипения и затем быстро охладить. Секрет заключен, конечно, в правильно подобранных ингридиентах. Как известно, молекула ДНК состоит из двух спиралей, каждая из которых представляет собой цепочку нуклеотидов.
Нуклеотиды бывают четырех разных видов и попарно соответствуют друг другу. Такие взаимно дополнительные нуклеотиды на противоположных ветвях ДНК соединяются и удерживают спирали вместе. Ребра пирамидки как раз и представляют собой такие двойные спирали. Подходя к вершине, ветви разделяются и расходятся вдоль двух других ребер, переплетаясь в двойную спираль уже с другими цепочками.
Каждая из цепочек как бы оконтуривает свою грань пирамидки, сплетаясь по дороге с такими же цепочками соседних граней. Теперь понятно, что цепочки ДНК должны содержать в нужных местах взаимно дополнительные последовательности нуклеотидов. Спроектировать такие молекулы — несложная олимпиадная задача по математике. Синтез небольших молекул ДНК по заданной последовательности нуклеотидов — давно освоенная техника. Так что производство нанопирамидок вполне можно поставить на поток.
Пирамидки, вроде той, что изображена на рисунке, имеют размер около 10 нанометров. Будучи составлены из треугольников, они, подобно стальной ферме, обладают высокой жесткостью и идеально подходят для сборки более крупных наноконструкций. Например, они могут служить основой для трехмерных электронных цепей.
Правда, для подобных применений нужно научиться соединять пирамидки между собой. На сегодняшний день уже обнаружено, что еще одна цепочка ДНК может служить своего рода клеем, соединяющим пирамидки в пары. Ученые сейчас работают над методом соединения множества пирамидок в более сложные структуры.
Источник: elementy.ru
ДНК и гены

ДНК (дезоксирибонуклеиновая кислота) – своеобразный чертеж жизни, сложный код, в котором заключены данные о наследственной информации. Эта сложная макромолекула способна хранить и передавать наследственную генетическую информацию из поколения в поколение. ДНК определяет такие свойства любого живого организма как наследственность и изменчивость.
Закодированная в ней информация задает всю программу развития любого живого организма. Генетически заложенные факторы предопределяют весь ход жизни как человека, так и любого др. организхма. Искусственное или естественное воздействие внешней среды способны лишь в незначительной степени повлиять на общую выраженность отдельных генетических признаков или сказаться на развитии запрограммированных процессов.
Дезоксирибонуклеи́новая кислота (ДНК) — макромолекула (одна из трёх основных, две другие — РНК и белки), обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков.
В клетках эукариот (животных, растений и грибов) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами.
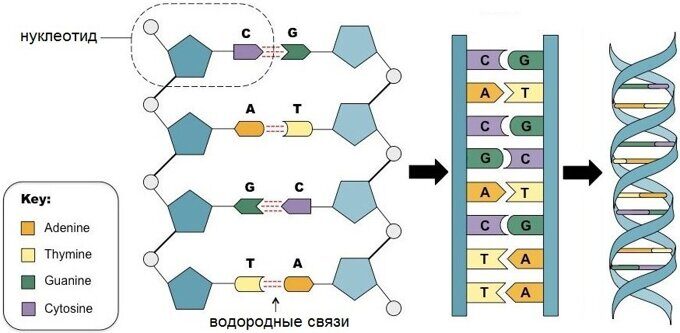
С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы (С) и фосфатной (Ф) группы (фосфодиэфирные связи).

Рис. 2. Нуклертид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы
В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула закручена по винтовой линии.
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином (А-Т), гуанин — только с цитозином (Г-Ц). Именно эти пары и составляют «перекладины» винтовой «лестницы» ДНК (см.: рис. 2, 3 и 4).

Рис. 2. Азотистые основания
Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции.

Рис. 3. Репликация ДНК
Расположение базовых комбинаций химических соединений ДНК и количественные соотношения между этими комбинациями обеспечивают кодирование наследственной информации.
Образование новой ДНК (репликация)
- Процесс репликации: раскручивание двойной спирали ДНК — синтез комплементарных цепей ДНК-полимеразой — образование двух молекул ДНК из одной.
- Двойная спираль «расстегивается» на две ветви, когда ферменты разрушают связь между базовыми парами химических соединений.
- Каждая ветвь является элементом новой ДНК. Новые базовые пары соединяются в той же последовательности, что и в родительской ветви.
По завершении дупликации образуются две самостоятельные спирали, созданные из химических соединений родительской ДНК и имеющие с ней одинаковый генетический код. Таким путем ДНК способна перерывать информацию от клетки к клетке.
Более подробная информация:
СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ
Рис. 4 . Азотистые основания: аденин, гуанин, цитозин, тимин
Дезоксирибонуклеиновая кислота (ДНК) относится к нуклеиновым кислотам. Нуклеиновые кислоты – это класс нерегулярных биополимеров, мономерами которых являются нуклеотиды.
НУКЛЕОТИДЫ состоят из азотистого основания, соединенного с пятиуглеродным углеводом (пентозой) – дезоксирибозой (в случае ДНК) или рибозой (в случае РНК), который соединяется с остатком фосфорной кислоты (H2PO3–).
Азотистые основания бывают двух типов: пиримидиновые основания – урацил (только в РНК), цитозин и тимин, пуриновые основания – аденин и гуанин.

Рис. 5. Структура нуклеотидов (слева), расположение нуклеотида в ДНК (снизу) и типы азотистых оснований (справа): пиримидиновые и пуриновые
Атомы углерода в молекуле пентозы нумеруются числами от 1 до 5. Фосфат соединяется с третьим и пятым атомами углерода. Так нуклеинотиды соединяются в цепь нуклеиновой кислоты. Таким образом, мы можем выделить 3’ и 5’-концы цепи ДНК:
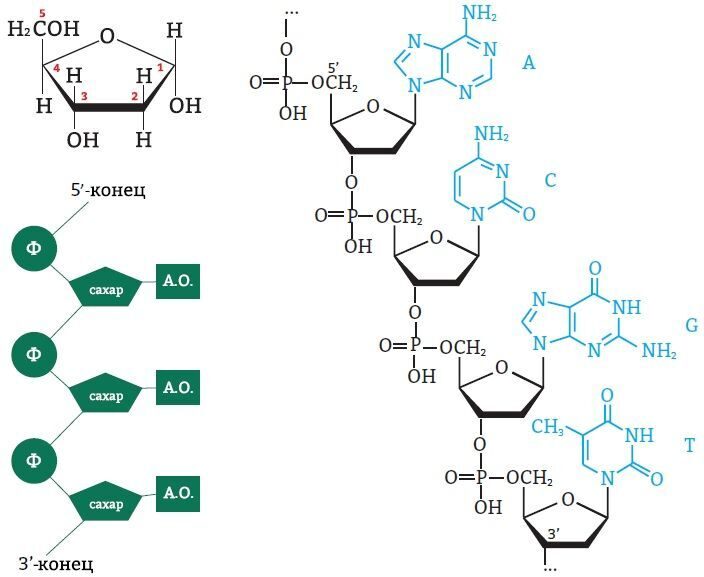
Рис. 6. Выделение 3’ и 5’-концов цепи ДНК
Две цепи ДНК образуют двойную спираль. Эти цепи в спирали сориентированы в противоположных направлениях. В разных цепях ДНК азотистые основания соединены между собой с помощью водородных связей. Аденин всегда соединяется с тимином, а цитозин – с гуанином. Это называется правилом комплементарности (см. принцип комплементарности ).
Правило комплементарности:
| A–T G–C |
Например, если нам дана цепь ДНК, имеющая последовательность
3’– ATGTCCTAGCTGCTCG – 5’,
то вторая ей цепь будет комплементарна и направлена в противоположном направлении – от 5’-конца к 3’-концу:
5’– TACAGGATCGACGAGC– 3’.

Рис. 7. Направленность цепей молекулы ДНК и соединение азотистых оснований с помощью водородных связей
РЕПЛИКАЦИЯ ДНК
Репликация ДНК – это процесс удвоения молекулы ДНК путем матричного синтеза. В большинстве случаев естественной репликации ДНК праймером для синтеза ДНК является короткий фрагмент РНК (создаваемый заново). Такой рибонуклеотидный праймер создается ферментом праймазой (ДНК-праймаза у прокариот, ДНК-полимераза у эукариот), и впоследствии заменяется дезоксирибонуклеотидами полимеразой, выполняющей в норме функции репарации (исправления химических повреждений и разрывов в молекле ДНК).
Репликация происходит по полуконсервативному механизму. Это значит, что двойная спираль ДНК расплетается и на каждой из ее цепей по принципу комплементарности достраивается новая цепь. Дочерняя молекула ДНК, таким образом, содержит в себе одну цепь от материнской молекулы и одну вновь синтезированную. Репликация происходит в направлении от 3’ к 5’ концу материнской цепи.

Рис. 8. Репликация (удвоение) молекулы ДНК
ДНК-синтез – это не такой сложный процесс, как может показаться на первый взгляд. Если подумать, то для начала нужно разобраться, что же такое синтез. Это процесс объединения чего-либо в одно целое. Образование новой молекулы ДНК проходит в несколько этапов:
1) ДНК-топоизомераза, располагаясь перед вилкой репликации, разрезает ДНК для того, чтобы облегчить ее расплетание и раскручивание.
2) ДНК-хеликаза вслед за топоизомеразой влияет на процесс «расплетения» спирали ДНК.
3) ДНК-связывающие белки осуществляют связывание нитей ДНК, а также проводят их стабилизацию, не допуская их прилипания друг к другу.
4) ДНК-полимераза δ (дельта) , согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5’→3′ на матрице материнской нити ДНК по направлению от ее 3′-конца к 5′-концу (скорость до 100 пар нуклеотидов в секунду). Этим события на данной материнской нити ДНК ограничиваются.

Рис. 9. Схематическое изображение процесса репликации ДНК: (1) Отстающая цепь (запаздывающая нить), (2) Ведущая цепь (лидирующая нить), (3) ДНК-полимераза α ( Polα ), (4) ДНК-лигаза, (5) РНК-праймер, (6) Праймаза, (7) Фрагмент Оказаки, (8) ДНК-полимераза δ ( Polδ ), (9) Хеликаза, (10) Однонитевые ДНК-связывающие белки, (11) Топоизомераза.
Далее описан синтез отстающей цепи дочерней ДНК (см. Схему репликативной вилки и функции ферментов репликации)
Нагляднее о репликации ДНК см. видео →
5) Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (альфа) и в направлении 5’→3′ синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК.
Вместо ДНК-полимеразы α к 3′-концу праймера присоединяется ДНК-полимераза ε .
6) ДНК-полимераза ε ( эпсилон) как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве 150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК . ДНК-полимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи.
7) ДНК-полимераза β ( бета) встает вместо ДНК-полимеразы ε , движется в том же направлении (5’→3′) и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε ). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи.
В результате на матрице материнской нити «лежит» фрагмент дочерней ДНК. Он называется фрагмент Оказаки .
8) ДНК-лигаза производит сшивку двух соседних фрагментов Оказаки , т.е. 5′-конца отрезка, синтезированного ДНК-полимеразой ε , и 3′-конца цепи, встроенного ДНК-полимеразой β .
СТРОЕНИЕ РНК
Рибонуклеиновая кислота (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов.
Так же, как ДНК, РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Однако в отличие от ДНК, РНК обычно имеет не две цепи, а одну. Пентоза в РНК представлена рибозой, а не дезоксирибозой (у рибозы присутствует дополнительная гидроксильная группа на втором атоме углевода). Наконец, ДНК отличается от РНК по составу азотистых оснований: вместо тимина (Т) в РНК представлен урацил (U) , который также комплементарен аденину.
Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Клеточные РНК образуются в ходе процесса, называемого транскрипцией , то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами.
Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией, т.е. синтеза белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.

Рис. 10. Отличие ДНК от РНК по азотистому основанию: вместо тимина (Т) в РНК представлен урацил (U), который также комплементарен аденину.
ТРАНСКРИПЦИЯ
Транскрипция – это процесс синтеза РНК на матрице ДНК. ДНК раскручивается на одном из участков. На одной из цепей содержится информация, которую необходимо скопировать на молекулу РНК – эта цепь называется кодирующей. Вторая цепь ДНК, комплементарная кодирующей, называется матричной.
В процессе транскрипции на матричной цепи в направлении 3’ – 5’ (по цепи ДНК) синтезируется комплементарная ей цепь РНК. Таким образом, создается РНК-копия кодирующей цепи.

Рис. 11. Схематическое изображение транскрипции
Например, если нам дана последовательность кодирующей цепи
3’– ATGTCCTAGCTGCTCG – 5’,
то, по правилу комплементарности, матричная цепь будет нести последовательность
5’– TACAGGATCGACGAGC– 3’,
а синтезируемая с нее РНК – последовательность
3’– AUGUCCUAGCUGCUCG – 5’.
ТРАНСЛЯЦИЯ
Рассмотрим механизм синтеза белка на матрице РНК, а также генетический код и его свойства. Также для наглядности по ниже приведенной ссылке рекомендуем посмотреть небольшое видео о процессах транскрипции и трансляции, происходящих в живой клетке:

В представленном видоролике (кнопка-ссылка слева) показан процесс образования белка из аминокислот. Наглядно (в анимированном варианте) продемонстрированы процессы транскрипции и трансляции. Биосинтез белка на рибосоме также кратко описан в разделе Аминокислоты белков . Более подробное видео о геноме, ДНК и ее структуре, а также процессах кодировки представленно ниже на данной странице:
Источник: propionix.ru