TTF наряду с Henry Hub используется для расчета цены на газ.
ИА Neftegaz.RU. Нейтральный индекс цен на газ TTF (Title Transfer Facility Natural Gas Price Index, TTF NGPI) представляет собой средневзвешенную по объему цену газа всех сделок, заключенных по всем спотовым контрактам, которые поставляются в определенный день (D) на TTF в Нидерландах.
Контракты заключаются на физическую доставку посредством передачи прав в отношении природного газа в Виртуальном торговом центре TTF), которым управляет Gasunie Transport Services (GTS), оператор системы передачи в Нидерландах.
Доставка производится одинаково каждый час в течение всего периода доставки с 06:00 (CET) в первый день месяца до 06:00 (CET) в первый день следующего месяца.
Окно расчета NGPI открывается за 2 газовых дня (D-2) до начала соответствующего газового дня (D) в 6 часов утра и заканчивается в соответствующий газовый день в 05:59:59 LET.
Расчет NGPI TTF основан на сделках, заключенных в часы TTF, TTF WD, TTF DA, TTF суббота, TTF воскресенье и контракты TTF W / END, праздничные дни и отдельные дни.
Финансовая грамотность. Что такое Индекс потребительских цен
Сделки W / END разделены на соответствующие дни.
Например, сделка с контрактом W / END в 30 МВт рассматривается как 720 МВтч в отдельный выходной день для расчета индекса.
NGPI постоянно рассчитывается и обновляется каждые 15 минут для D (текущий день доставки газа), D + 1 (следующий день доставки газа) и D + 2 (день после следующего дня доставки газа) в файле.
После окончания дня газа D окончательная цена нейтрального газа дня D публикуется как минимум в 6:10 LET и используется в качестве окончательной и исторической справочной цены для этого дня газа («D»).
Европейская энергетическая биржа (EEX) успешно интегрировала Powernext и Gaspoint Nordic состоянию на 1 января 2020 г.
В результате чего весь портфель природного газа, ранее предлагавшийся на PEGAS, был переведен в EEX.
Были получены все необходимые разрешения для интеграции спотового и деривативного рынков природного газа в EEX.
Все правила расчета для справочных цен и индексов опубликованы в EEX Market Notices.
Цена на природный газ также формируется на основе стоимости фьючерсного контракта на эталонный сорт газа Henry Hub, который торгуется на американской фондовой площадке NYMEX.
Intercontinental Exchange (ICE) — сеть бирж и клиринговых палат для финансовых и товарных рынков в США, Канаде и Европе, крупнейший в мире оператор срочного рынка, где торгуются фьючерсные контракты на все виды базовых активов, в тч. энергоносители.
И TTF, и NBP летом 2020 г. торгуются с премией к Henry Hub летом 2020 года, поскольку объемы экспорта из США «сокращаются».
По мере того как экспортный газ вытесняется обратно на рынок США с большими запасами газа, Henry Hub упал до самого низкого уровня за 25 лет
Источник: neftegaz.ru
Как рассчитывается Индекс потребительских цен?
Селективный индекс от 1С — что выберет MS SQL?
Большие объемы данных вынуждают глубже смотреть в логику работы оптимизатора СУБД. Ваше понимание о селективном индексе может расходится с логикой оптимизатора SQL. Это еще больше привязывает конкретную систему к конкретной СУБД. Построение хорошего запроса к СУБД попрежнему остается искусством, а искусственный интеллект пока еще туда не добрался
Кто он – селективный индекс.
В предыдущей статье Партицированная дисциплина программиста был показан пример запроса на соединение двух таблиц для регистра сведений, и показано как MS SQL выбирает потоки данных для merge join с использованием стандартных индексов 1С. В частности было отмечено, что без дополнительных условий в Index seek, в поток для Megre join попадают все записи индекса и приходится указывать дополнительные фильтры для ограничения. Вопрос: почему так происходит? — остался открытым.
Все что описано ниже, это мои выводы на основании анализа поведения оптимизатора MS SQL 2019 в разных условиях. Официально изложенных алгоритмов, которые использует оптимизатор MS SQL я не нашел, если знаете ссылку пишите в комментариях.
Сначала вспомним понятие селективного индекса
Если сказать кратко – индекс для данного запроса является селективным, если при его использовании можно выбрать
- Больше уникальных строк
- С меньшим количеством дублей
- Наименьшее количество строк на каждую комбинацию ключевых значений
Про селективность хорошо написано тут (правда для Oracle, но это же общая концепция) Что такое селективный индекс
Возьмем оптимизированный запрос из предыдущей статьи
И опять его запустим со стандартными индексами 1С. MS SQL нас интересует последний запрос
Смотрим общую цену, которую зафиксировал оптимизатор — в попугаях 7767
План получается с Index Seek по типовому индексу _InfoR18860_ByDims18897_STRRRR
План запроса ниже, видно, что основная тяжесть ввода вывода идет на Index Seek и операции Merge
Вроде все хорошо, по правилам и предсказуемо, но давайте добавим ему другой индекс в котором, убрано поле _Fld628 . Это поле содержит 0 поскольку в типовой конфигурации есть, но не используются
Смотрим результат. Неожиданно – SQL сервер выбрал новый индекс сам , даже при том что _Fld628 (разделителя) там вообще нет! Хотя есть индекс _InfoR18860_ByDims18897_STRRRR который формально удовлетворяет всем условиям.
План при этом получился лучше, но ненамного
Мы выбираем селективный индекс, а оптимизатор выбирает …
Почему MS SQL так сделал?
Сначала я подумал так «Скорее всего поле, где _Fld628 = 0 в каждой записи, убивает всю селективность индекса и как только появляется достойная альтернатива, то MS SQL сам бежит к ней»
Но после обсуждения на Хабре и нескольких экспериментов выяснилось, что дело в количестве IO по индексу
Т.е. по индексу _InfoR18860_ByDims18897_STRRRR фактическая статистика показала почти 5 млн чтений
а по индексу _InfoR18860_MySuperWithoutFld628_ByDims18897_STRRRR около 3 млн чтений, причем через Index Scan. Индекс _InfoR18860_MySuperWithoutFld628_ByDims18897_STRRRR явно не укладывается в критерии селективности, но оптимизатор MS SQL видит, что по нему работать быстрее
Фрагментация у стандартного индекса действительно была, и после Rebuild оптимизатор опять начал его выбирать как основной! Более того – посмотрите как уменьшилось количество чтений до 3.4 миллиона
Вывод: Селективность для оптимизатора MS SQL это уже не основной показатель и как показано ниже для других СУБД тоже. Оптимизатор MS SQL может отказаться использовать селективный индекс даже при сильной фрагментации. Более того, в статье MS SQL Server: ваши статистики не работают! Так ли все плохо на самом деле? видно, что поле разделителя влияет на качество статистик MS SQL
Вопрос А в какое место индекса, тогда поставить это поле _Fld628 (ОбластьДанныхОсновныеДанные) , которое 1С по умолчанию ставит в начало (префикс) всех индексов?
Но все очень зависит от СУБД , например тут описаны мифы о селективных индексах причем с планами для разных СУБД
Скачать файлы
Специальные предложения












Никаких included columns нет, В индексе _InfoR18860_MySuperWithoutFld628_ByDims18897_STRRRR поля _Fld628 нет
>Можете приложить актуальные планы в xml формате?
Я в текстовом приложил в конце статьи они хорошо открываются моноширийным шрифтом в 1С . Вам чтото там не хватает ?
XML мне нужно заново гонять запрос.
Никаких included columns нет, В индексе _InfoR18860_MySuperWithoutFld628_ByDims18897_STRRRR поля _Fld628 нет
Тогда не очень понятно, как вообще этот индекс используется, если в нём нет поля по которому фильтрация идёт
Я в текстовом приложил в конце статьи они хорошо открываются моноширийным шрифтом в 1С . Вам чтото там не хватает ?
Да, не хватает, в xml гораздо больше информации содержится. Да и просто смотреть удобнее
Ну в принципе в моей статье есть ответ
В обсуждении на хабре (про Пола Вайта) можете увидеть что это бывает при наличии фрагментации
https://habr.com/ru/post/691326/
XML попробую заново получить как будет время, если обсуждение на хабре не снимет вопросы
Ну в принципе в моей статье есть ответ
В обсуждении на хабре (про Пола Вайта) можете увидеть что это бывает при наличии фрагментации
Нет, я про другое немного удивлялся — если в индексе в принципе нет поля _Fld628, то фильтрация по нему в принципе не должна работать в этом индексе, соот. не может получиться такой план, как на скринах вижу. Но с утра, на свежую голову, сообразил, что _Fld628 скорее всего PK (или его часть), а значит всё же там присутствует. Впрочем, на хабре про это уже тоже написали
Вывод: Селективность для оптимизатора MS SQL это уже не основной показатель и как показано ниже для других СУБД тоже. Оптимизатор MS SQL может отказаться использовать селективный индекс даже при сильной фрагментации.
Сама по себе селективность индекса — это сферический конь в вакууме, нужно смотреть на селективность предикатов в запросе, а тут уже на одном и том же индексе селективность может очень сильно гулять. А поскольку оптимизатор в mssql стоимостный, то и планы с разными входными параметрами могут быть сильно разные.
Степень фрагментации,емнип, учитывается достаточно опосредованно — напрямую её оптимизатор не видит, но видит количество страниц в индексе. При прочих равных в сильно фрагментированном их будет больше, стоимость узла увеличится, это тоже может повлиять на итоговый план
Не знаю где Вы видите первичный ключ в нетрадиционном индексе,
CREATE NONCLUSTERED INDEX [_InfoR18860_MySuperWithout_Fld628_ByDims18897_STRRRR] ON [dbo].[_InfoRg18860]
(
[_Fld18865] ASC,
[_Period] ASC,
[_Fld18861RRef] ASC,
[_Fld18863RRef] ASC,
[_Fld19363RRef] ASC,
[_Fld18862RRef] ASC
)WITH (PAD_INDEX = OFF, STATISTICS_NORECOMPUTE = OFF, SORT_IN_TEMPDB = OFF, DROP_EXISTING = OFF, ON LINE = OFF, ALLOW_ROW_LOCKS = ON, ALLOW_PAGE_LOCKS = ON, OPTIMIZE_FOR_SEQUENTIAL_KEY = OFF) ON [AGRREG]
GO
Стандартный индекс он даже привлекательней поскольку уникальный, но никаких Constraints 1С не создает
/****** Object: Index [_InfoR18860_ByDims18897_STRRRR] Script Date: 10/19/2022 11:26:48 AM ******/
CREATE UNIQUE NONCLUSTERED INDEX [_InfoR18860_ByDims18897_STRRRR] ON [dbo].[_InfoRg18860]
(
[_Fld628] ASC,
[_Fld18865] ASC,
[_Period] ASC,
[_Fld18861RRef] ASC,
[_Fld18863RRef] ASC,
[_Fld19363RRef] ASC,
[_Fld18862RRef] ASC
)WITH (PAD_INDEX = OFF, STATISTICS_NORECOMPUTE = OFF, SORT_IN_TEMPDB = OFF, IGNORE_DUP_KEY = OFF, DROP_EXISTING = OFF, ON LINE = OFF, ALLOW_ROW_LOCKS = ON, ALLOW_PAGE_LOCKS = ON, OPTIMIZE_FOR_SEQUENTIAL_KEY = OFF) ON [AGRREG]
GO
Кластерный индекс , в данной ситуации не поможет так как там есть поле [_Fld18861RRef] ASC, — ИсходнаяСистема , которое в нашем запросе не используется, а оно его разрывает
/****** Object: Index [_InfoR18860_ByPeriod_TRSRRR] Script Date: 10/19/2022 11:28:15 AM ******/
CREATE UNIQUE CLUSTERED INDEX [_InfoR18860_ByPeriod_TRSRRR] ON [dbo].[_InfoRg18860]
(
[_Fld628] ASC,
[_Period] ASC, —Период
[_Fld18861RRef] ASC, — ИсходнаяСистема
[_Fld18865] ASC, —ИдИсходной системы
[_Fld18863RRef] ASC,
[_Fld19363RRef] ASC,
[_Fld18862RRef] ASC
)WITH (PAD_INDEX = OFF, STATISTICS_NORECOMPUTE = OFF, SORT_IN_TEMPDB = OFF, IGNORE_DUP_KEY = OFF, DROP_EXISTING = OFF, ON LINE = OFF, ALLOW_ROW_LOCKS = ON, ALLOW_PAGE_LOCKS = ON, OPTIMIZE_FOR_SEQUENTIAL_KEY = OFF) ON [AGRREG]
GO
Что подразумевается под селективностью предикатов? Rows в фактическом плане? Она тут одинакова, я это показал на картинках со сравнением(+ можно в приложенных файлах посмотреть) разница только в способе выборке и итоговой цене
В целом мой посыл таков — раз мы не можем принуждать СУБД хинтами, то единственный вариант повысить эффективность использования индексов это Селективность + Оптимальная структура хранения (в том числе фрагментация), ведь после дефрагментации стандартный селективный индекс опять стал эффективным.
Более интересный вопрос с _Fld628 поле с низкой кардинальностью, стоит ли его ставить всегда в начало индекса как делает 1С? Напр в регистре бухгалтерии присуствует поле Организация, но за счет другой схемы построения стандартных индексов оно не мешает 😉
Источник: infostart.ru
Рацион опухолевых клеток, или роль питания в терапии рака

Обзор
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Корректировка диеты часто применяется для лечения и профилактики заболеваний. Онкологические заболевания — не исключение: правильное питание может служить не только профилактической мерой, но и повышать эффективность терапии. Здесь мы предлагаем обсудить «вкусовые предпочтения» раковых клеток и разобраться в том, как отдельные питательные вещества могут помочь бороться с опухолью.

Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение: на вкус и цвет товарищей нет
С начала 1980-х годов ведущие организации здравоохранения выпускают рекомендации по питанию и образу жизни, которые позволяют снизить индивидуальный риск развития рака. Данные рекомендации основаны на результатах метаанализов эпидемиологических исследований (иными словами, анализ многолетнего опыта миллионов людей, которые питались тем или иным образом). Эти рекомендации универсальны и просты в исполнении: они не требуют подсчета калорий, строгого контроля состава продуктов, а лишь предлагают общую схему и принцип питания для поддержания здорового веса (рис. 1).
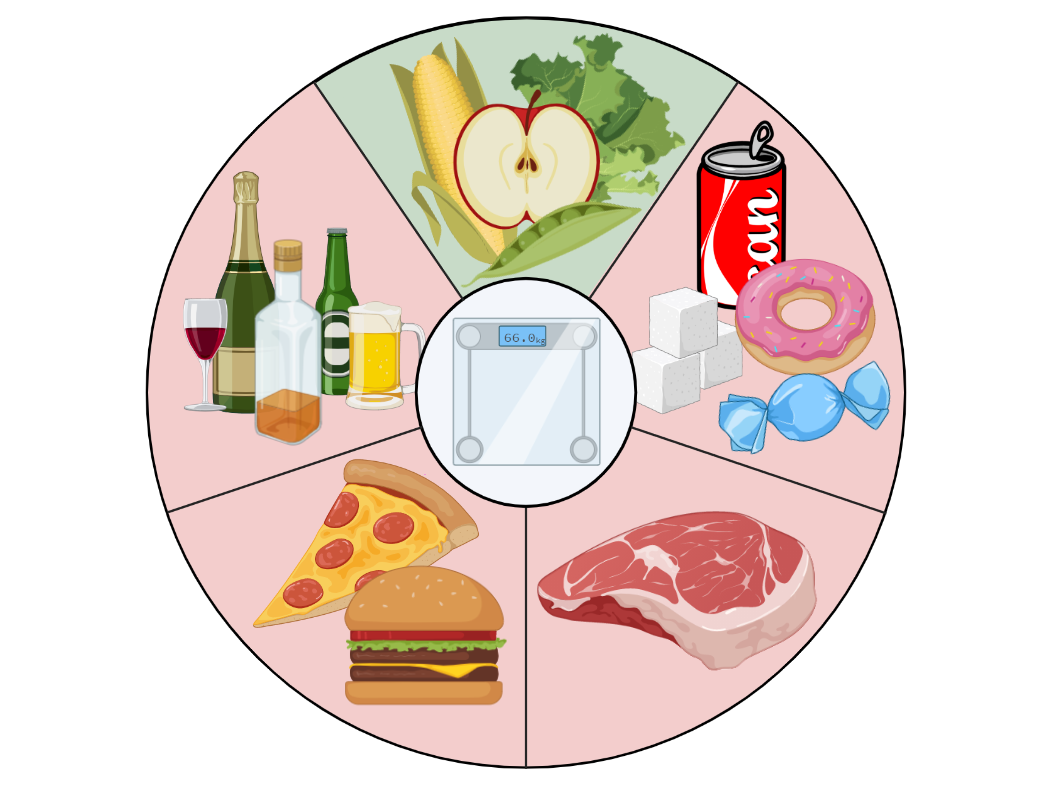
Рисунок 1. Рекомендации по питанию, которые направлены на снижение вероятности возникновения онкологических заболеваний. Ежедневный рацион должен включать фрукты, овощи, бобовые культуры, цельнозерновые крупы. По возможности, необходимо ограничивать употребление красного мяса, сахара, сладких газированных напитков и алкоголя. Следование данным советам позволит поддерживать здоровый вес в течение всей жизни и снизить индивидуальный риск развития рака.
коллаж авторов статьи. Создан с помощью BioRender.com
Подобного рода советы относятся к здоровым людям, тогда как для людей, страдающих онкологическими заболеваниями, стандартных рекомендаций по питанию не существует. В то же время, питание пациентов может сильно влиять на успешность терапии злокачественных образований [1]. Почему для людей, больных раком, нельзя составить универсальные рекомендации по составу пищи?
Ответ на этот вопрос следует из принципов, согласно которым развиваются все опухоли [2]. Изначально клетка, которая в будущем даст начало опухоли, ничем не отличается от своих соседей. По мере накопления мутаций нормальные клетки могут постепенно эволюционировать и приобретать черты раковых клеток [3], [4]. В 2000 году среди многочисленных особенностей рака, в легендарном обзоре Hallmarks of cancer [3] были обозначены основные признаки, которые определяют биологию опухолевой клетки (рис. 2).
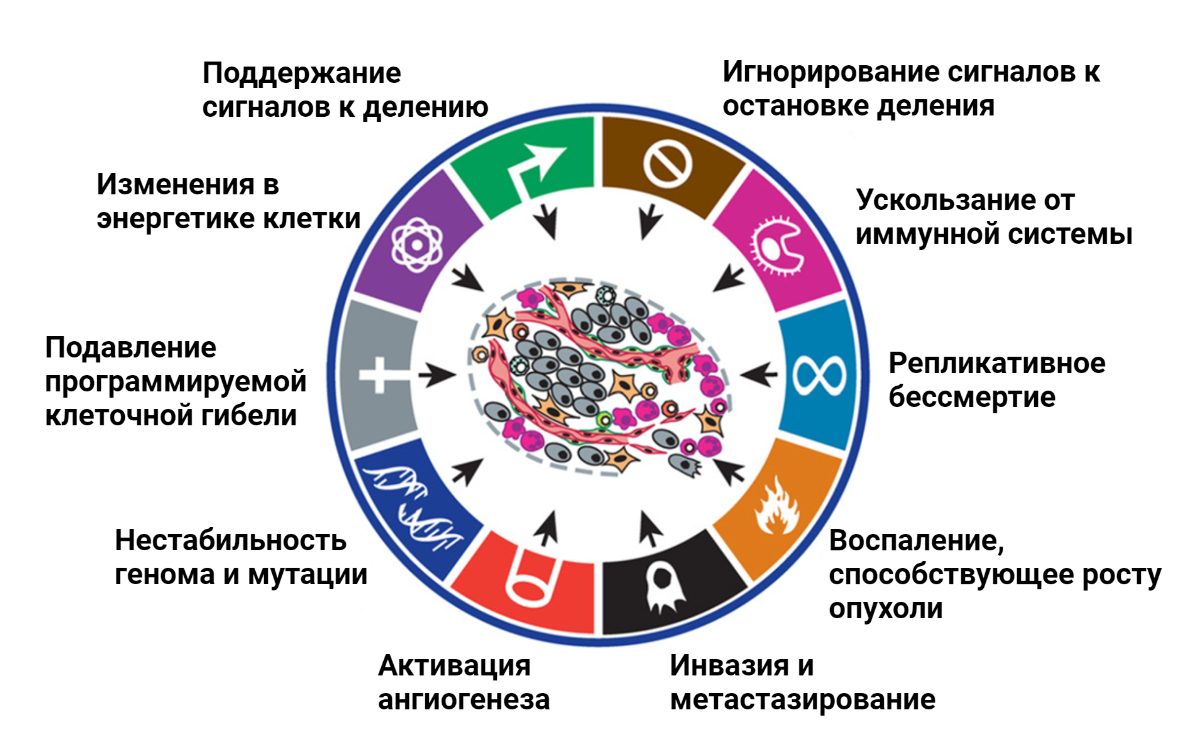
Рисунок 2. Особенности опухолевых клеток (hallmarks of cancer), которые отличают их от нормальных. Были сформулированы в 2000 году [3] и затем дополнены в 2011 [4].
Важнейшей особенностью всех раковых клеток является нестабильность генома, которая приводит к огромному генетическому разнообразию опухолей. Несмотря на ряд свойств, присущих всем раковым клеткам, каждая опухоль обладает уникальным набором мутаций, которые и определяют ее агрессивность, скорость роста, эффективность терапии. Генетическое разнообразие опухолей является основной преградой для составления универсальных рекомендаций по питанию для пациентов.
В последнее время исследователи активно изучают влияние питательных веществ на прогрессию опухоли и эффективность лечения. В основном проводятся экспериментальные работы на животных моделях, но есть и немногочисленные клинические исследования. Мы предлагаем читателям познакомиться поближе с особенностями метаболизма опухолевой клетки. Попытаемся разобраться, как вещества, потребляемые с пищей, могут влиять на опухоль и ее окружение. И, наконец, попробуем ответить на вопрос: может ли диета помочь в борьбе с раком?
Метаболизм
Для того, чтобы разобраться в тонкостях метаболизма раковой клетки, кратко вспомним основные принципы и термины биоэнергетики. Метаболизм — это совокупность химических превращений в клетке, которые направлены на получение энергии и необходимых веществ. Только посмотрите, какое бесчисленное количество реакций включает в себя метаболизм (рис. 3)!
Все метаболические пути можно условно разделить на биодеградацию (катаболизм) и биосинтез (анаболизм) [5]. Катаболизм приводит к получению энергии в виде макроэргических соединений (таких как АТФ), а также NADH, NADPH и FADH2 — коферментов, участвующих в окислительно-восстановительных реакциях. Анаболические процессы используют запасенную энергию для синтеза молекул, необходимых для жизни клетки: жиров, нуклеотидов, белков, углеводов.
Рисунок 3. Метаболическая карта — схема, объединяющая основные метаболические пути в клетке.
Метаболизм тесно связан с питанием: ежедневно мы потребляем питательные вещества, которые, с одной стороны, участвуют в катаболических реакциях и поставляют энергию клеткам, а с другой — необходимы для синтеза собственных молекул. Углеводы, белки и жиры, которые мы потребляем, разрушаются в пищеварительном тракте до мономерных единиц: углеводы до моносахаридов (глюкоза, фруктоза и др.), жиры до жирных кислот и глицерина, белки до аминокислот. Эти молекулы поступают в клетки организма и принимают участие в метаболических процессах.
В раковой клетке зачастую увеличена активность некоторых метаболических ферментов или целых метаболических путей, а значит, и потребность в питательных веществах у клеток опухоли может отличаться от нормальных клеток [6]. Эти особенности могут быть учтены при лечении опухоли: исключение из рациона пациента определенных компонентов пищи приведет к понижению их содержания в плазме крови, а следовательно, и в окружении раковых клеток, что негативно скажется на их размножении. Кроме этого, некоторые элементы питания могут непосредственно влиять на противоопухолевый иммунитет, что также должно быть учтено при составлении диеты.
Глюкоза
Глюкоза является основным источником энергии для живых организмов. В нормальном рационе человека она встречается как в свободном виде, так и в составе олиго- и полисахаридов (например, в сахарозе, лактозе и мальтозе).
Одним из важнейших биоэнергетических путей в клетке является гликолиз — последовательность химических реакций, в результате которых из 1 молекулы глюкозы получается 2 молекулы пировиноградной кислоты, 2 молекулы АТФ и 2 молекулы NADH. Затем пировиноградная кислота может быть вовлечена в цикл трикарбоновых кислот (цикл Кребса) — биохимический процесс, протекающий в митохондриях, который поставляет NADH и FADH2 что, в конечном счете, делает возможным синтез АТФ посредством окислительного фосфорилирования. При этом из 1 молекулы глюкозы можно получить приблизительно 36 молекул АТФ, что гораздо более выгодно с точки зрения энергетики, нежели просто гликолиз. Вследствие этого большинство клеток активно использует цикл трикарбоновых кислот и окислительное фосфорилирование для получения энергии.
Тем не менее, известно множество случаев, когда по разным причинам клетки смещают баланс в сторону гликолиза, используя этот путь в качестве основного источника энергии, ингибируя ферменты цикла трикарбоновых кислот или активируя ферменты гликолиза.
Давно известно, что опухолевые клетки активно используют гликолиз, несмотря на его относительно низкую эффективность с точки зрения энергетической выгоды. Это явление было открыто Отто Генрихом Варбургом в 1924 году. Сам Варбург считал, что нарушение клеточного дыхания — главная причина развития опухоли.
Однако оказалось, что клеточное дыхание в большинстве опухолевых клеток не нарушено, а просто подавляется из-за активного гликолиза. Сейчас понятно, что активный гликолиз дает преимущество опухолевым клеткам. Во-первых, гликолиз протекает без кислорода, и, по-видимому, во многом является адаптацией к гипоксии, которая развивается по мере удаления опухолевых клеток от кровеносных сосудов. Частично эта проблема также решается тем, что раковые клетки могут способствовать ангиогенезу — прорастанию сосудов в опухоль за счет продукции ангиогенных факторов, например фактора роста эндотелия сосудов (VEGF, Vascular endothelial growth factor). Во-вторых, активный гликолиз сопряжен с образованием большого количества молочной кислоты, что приводит к закислению среды, тем самым способствуя инвазии опухоли за счет разрушения нормальных популяции клеток и деградации внеклеточного матрикса.
В то же время, нельзя не отметить тот факт, что эффект Варбурга наблюдается не только в опухолевых клетках, но и вообще во всех активно пролиферирующих клетках. Глюкоза — один из основных источников углерода в клетке, и ее полное окисление в цикле трикарбоновых кислот идет вразрез с потребностями пролиферирующей клетки. Некоторая часть глюкозы, а точнее, ее метаболитов, должна быть направлена на пути биосинтеза аминокислот, нуклеотидов и жирных кислот. Важную роль в производстве предшественников нуклеотидов и аминокислот, а также NADPH, необходимого для синтеза жирных кислот, играет пентозофосфатный путь — альтернативный путь окисления глюкозы, который также имеет ключевое значение в поддержании роста раковых клеток.
Итак, глюкоза особенно необходима раковым клеткам в связи с их активным размножением; при этом она служит не только источником энергии, но и важным предшественником для синтеза аминокислот, нуклеотидов и жирных кислот. Однако помимо непосредственной роли глюкозы в клеточном метаболизме, важным физиологическим аспектом также является эффект инсулина на опухолевые клетки.
Как известно, повышение уровня глюкозы в крови вызывает секрецию гормона инсулина бета-клетками поджелудочной железы. Инсулин, в свою очередь, взаимодействует с инсулиновыми рецепторами на поверхностях клеток. Взаимодействие инсулина с его рецептором приводит к активации фосфатидилинозитол-3-киназы (PI3K) — ключевого фермента PI3K/AKT/mTOR сигнального пути: работа PI3K делает возможным фосфорилирование протеинкиназы Akt, что приводит, с одной стороны, к транслокации глюкозных транспортеров на клеточную мембрану (и, как следствие, к увеличению поглощения глюкозы клетками), а с другой стороны — к активации протеинкиназы mTORС1, важнейшего регулятора клеточного метаболизма и роста [1].
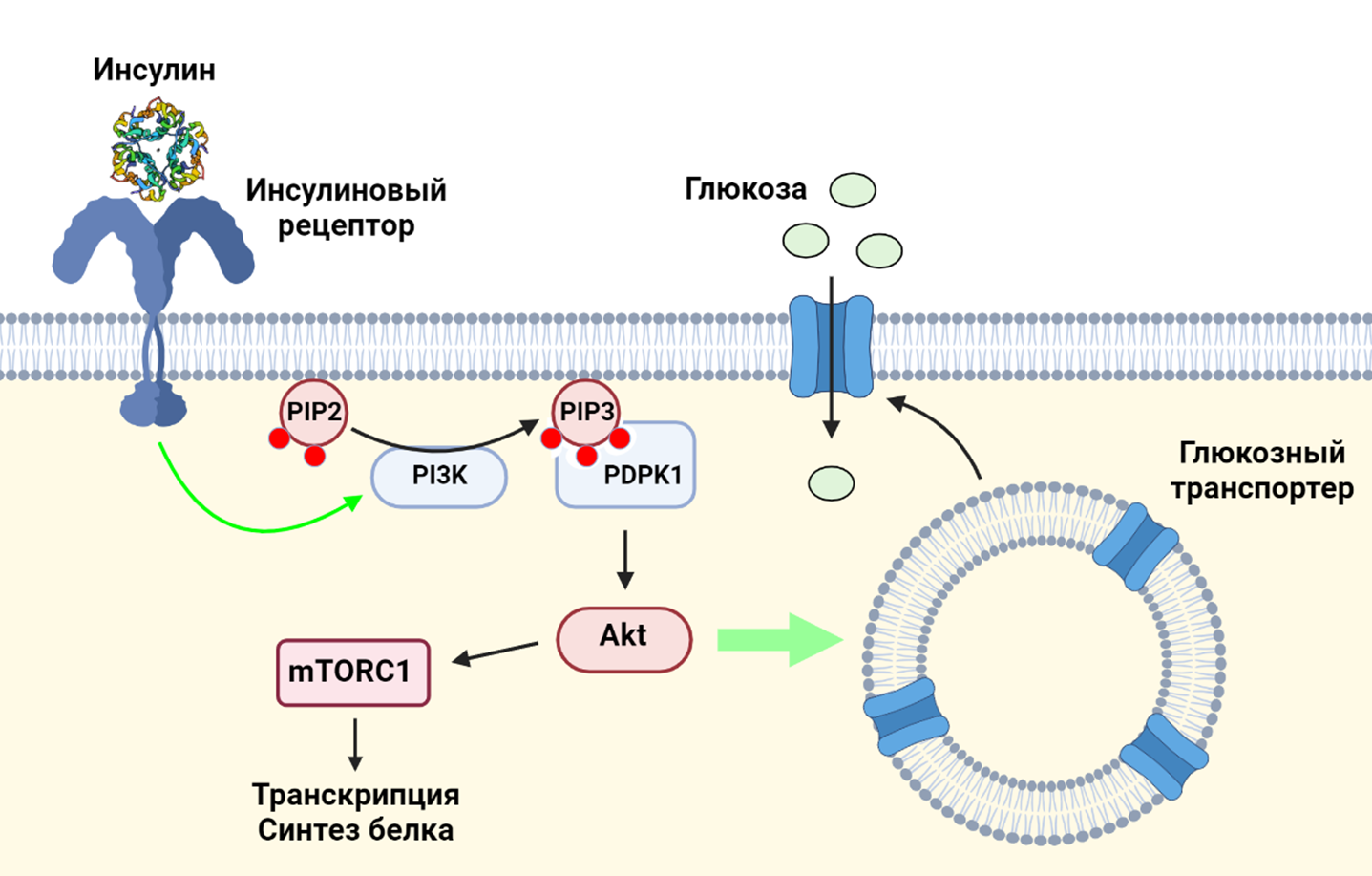
Рисунок 4. Взаимодействие инсулина и его рецептора приводит к активации фосфатидилинозитол-3-киназы (PI3K), которая фосфорилирует фосфатидилинозитолдифосфат (PIP2). Образовавшийся фосфатидилинозитолтрифосфат (PIP3) нужен для того, чтобы фосфоинозитид-зависимая киназа-1 (PDPK1) активировала протеинкиназу Akt. Akt необходима для стыковки внутриклеточных везикул, несущих глюкозный транспортер, с клеточной мембраной. Также Akt активирует mTORC1.
коллаж авторов статьи. Создан с помощью BioRender.com
Сигнальный путь PI3K/AKT/mTOR играет важную роль в раковых клетках, которые могут активно экспрессировать рецепторы к инсулину и, получая сигналы при их стимуляции, увеличивать темпы роста и размножения.
А что насчет других углеводов?
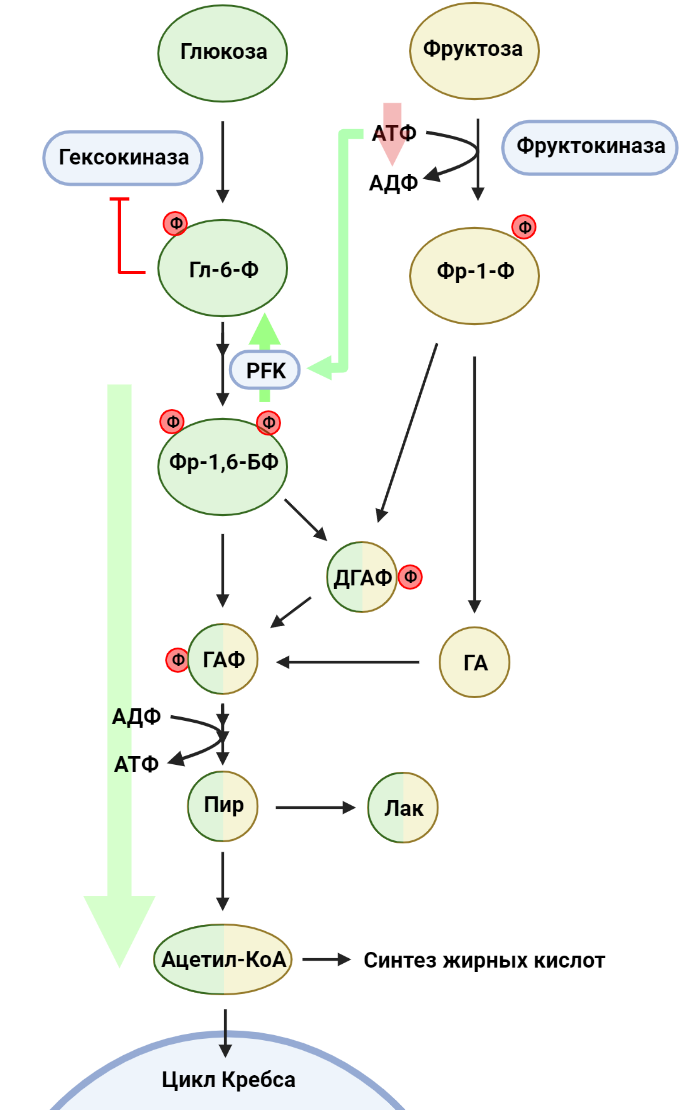
Рисунок 5. Метаболизм фруктозы. В первой стадии гликолиза глюкоза фосфорилируется до глюкозо-6-фосфата (Гл-6-Ф). Параллельно фруктоза фосфорилируется до фруктозо-1-фосфата (Фр-1-Ф). Фруктоза-1,6-бисфосфат (Фр-1,6-БФ), продукт фосфофруктокиназы (PFK), распадается на глицеральдегидфосфат (ГАФ) и дигидроксиацетонфосфат (ДГАФ), а Фр-1,6-БФ расщепляется на ДГАФ и глицеральдегид (ГА).
ДГАФ и ГА переходят в ГАФ, который в оставшихся реакциях гликолиза превращается в пируват (ПИР). ПИР может восстановиться до лактата (ЛАК) или подвергаться превращению в ацетил-КоА, соединение, использующееся в многих биохимических процессах.
коллаж авторов статьи. Создан с помощью BioRender.com
Помимо глюкозы, в наш ежедневный рацион входит множество других углеводов. Например, фруктоза, один из наиболее распространенных в природе сахаров, встречается в пище как в свободном виде, так и в составе олигосахаридов, например, сахарозы. Эпидемиологи связывают рост потребления сахаросодержащих напитков с увеличением частоты заболеваемости раком [8].
Более того, оказывается, что даже умеренное потребление фруктозы (эквивалентное одной банке газировки в день) оказывает негативное воздействие и может способствовать росту опухоли, что было отмечено в экспериментах с мышами на примере колоректального рака [9]. Глюкоза эффективно поглощается эпителиальными клетками тонкого кишечника за счет специальных белков, осуществляющих совместный транспорт глюкозы и ионов натрия.
При этом транспорт фруктозы опосредуется пассивным транспортером GLUT5 и потому менее эффективен. В результате значительная часть потребляемой фруктозы проходит тонкую кишку и попадает в толстый кишечник.
В случае колоректального рака фруктоза становится одним из потенциальных питательных веществ для опухолевых клеток: действительно, раковые клетки в кишечнике активно экспрессируют как GLUT5, так и ферменты, метаболизирующие фруктозу. Глюкоза и фруктоза похожи между собой с точки зрения строения молекул, однако с точки зрения их метаболизма они немного отличаются (рис. 5).
Если говорить про глюкозу, то первая стадия гликолиза представляет собой фосфорилирование глюкозы с затратой АТФ и образованием глюкозо-6-фосфата, причем активность гексокиназ (ферментов, осуществляющих эту реакцию) зависит от концентрации глюкозо-6-фосфата в среде: чем больше продукта для фермента, тем менее активно он работает. Это явление — пример отрицательной обратной связи, важного аспекта регуляции активности метаболических путей.
Фруктоза же в первую очередь фосфорилируется фруктокиназой до фруктозо-1-фосфата (Фр-1-Ф), также с затратой АТФ, однако в данном случае активность фермента не зависит от концентрации продукта. Это значит, что киназа будет фосфорилировать всю доступную фруктозу, вне зависимости от того, сколько Фр-1-Ф уже было сделано. Следовательно, при повышенной концентрации фруктозы клетка будет тратить много АТФ на ее фосфорилирование. В ответ на понижение уровня АТФ активируется фермент глизолиза фосфофруктокиназа (PFK), а также, помимо этого, продукты расщепления Фр-1-Ф в конечном счете попадают в реакции гликолиза. Таким образом, фруктоза усиливает гликолиз, что на руку раковым клеткам: в случае колоректального рака активация гликолиза способствует индукции синтеза жирных кислот, необходимых для роста опухоли [9].
Надо отметить, что фруктоза, хоть и способствует росту опухолей в случае колоректального рака, для роста и выживания нормальных клеток вовсе не обязательна, так что фармакологическое подавление переносчиков фруктозы и ферментов, участвующих в ее метаболизме (например, фруктокиназы) может препятствовать прогрессии колоректального рака. И конечно же, исключение фруктозы из рациона пациента также может оказывать благотворный эффект на течение болезни. Однако клинических данных, подтверждающих это, пока недостаточно [1].
Еще один любопытный пример связан с маннозой, моносахаридом, который также часто встречается в рационе как в свободном виде, так и в составе полисахаридов. Манноза поглощается теми же транспортерами, что и глюкоза, но затем накапливается в клетках в виде маннозо-6-фосфата и дальше почти не метаболизируется.
В то же время, маннозо-6-фосфат ингибирует некоторые ферменты гликолиза (гексокиназу и глюкозоизомеразу), а также глюкозо-6-фосфатдегидрогеназу — первый фермент пентозофосфатного пути, альтернативного способа окисления глюкозы. Таким образом, накопление маннозо-6-фосфат влечет за собой подавление метаболизма глюкозы, что негативно сказывается на жизнеспособности раковых клеток.
Однако не все опухоли чувствительны к маннозе. Дело в том, что в клетках есть фермент маннозо-6-фосфат—изомераза (PMI), который катализирует превращение маннозо-6-фосфата в фруктозо-6-фосфат, метаболит гликолиза. Казалось бы, накопление маннозо-6-фосфата перестает быть проблемой для клетки, но дело в том, что разные опухоли имеют разную активность PMI, и если в каких-то опухолевых клетках его активность понижена, то манноза будет подавлять рост опухоли. Оказалось, что колоректальные опухоли обычно имеют очень низкие уровни PMI, и действительно, на мышиной модели колоректального рака было показано, что биодобавки, содержащие маннозу, значительно подавляют рост опухолей и не оказывают отрицательный эффект на здоровье и вес мышей [10]. Возможно, применение маннозы в виде добавок к пище будет повышать эффективность терапии колоректального рака и у людей, но клинических исследований на этот счет еще не проводилось [1].
Жирные кислоты
Жирные кислоты являются важнейшим источником энергии в клетке, особенно для «энергозатратных» тканей вроде скелетной и сердечной мышечных тканей. При окислении жирных кислот (которое в основном происходит в ходе процесса β-окисления) образуются NADH и FADH2, а также ацетил-КоА — вещества, необходимые для синтеза АТФ при окислительном фосфорилировании. Более того, если сравнить между собой жирные кислоты и углеводы, то окажется, что по отношению к своей сухой массе жирные кислоты обеспечивают больше АТФ, чем углеводы, а значит, они лучше подходят на роль запасного питательного вещества (жирные кислоты запасаются в форме триглицеридов в жировой ткани). Разумеется, не могло бы случиться такого, чтобы не нашлось опухолевых клеток, активно использующих жирные кислоты как источник энергии и восстановительных эквивалентов. Действительно, описаны процессы, когда раковая клетка переходит на β-окисление, а также отдельные опухоли, для которых основной источник энергии — это жиры, а не углеводы [1], [11].
Так, было показано, что окисление жирных кислот критично для клеток рака груди при их откреплении от матрикса. Протоки молочных желез выстланы слоем эпителиальных клеток, которые дают начало опухоли.
На ранних стадиях развития рака молочной железы опухолевые клетки открепляются от матрикса, покидают свои ниши, начинают пролиферировать в просветах полых железистых структур, заполняя их. Эпителиальные клетки имеют на своей поверхности рецепторы эпидермального фактора роста (epidermal growth factor receptor, EGFR).
При стимуляции EGFR, помимо прочего, происходит активация сигнального пути PI3K/AKT/mTOR, что приводит к росту, пролиферации, а также способствует поглощению глюкозы и подавлению апоптоза. Для эпителиальной клетки очень важен контакт с внеклеточным матриксом.
Если клетка по какой-либо причине теряет контакт с матриксом, то экспрессия EGFR падает, и, как одно из следствий, клетка начинает испытывать дефицит в глюкозе. В норме эта череда событий непременно приведет к нехватке АТФ, окислительному стрессу, и наконец — к аноикису— гибели клетки, происходящей в ответ на открепление от матрикса. Но опухолевая клетка не так проста и активно пытается спастись от апоптоза. Активность ряда онкогенов в данном случае способствует активации окисления жирных кислот, что обеспечивает клетку энергией и предотвращает гибель [12].
Другой важный пример роли жирных кислот в раковых клетках связан с никотинамидадениндинуклеотидфосфатом (NADPH) — веществом, которое выполняет две основные функции. С одной стороны, он участвует в защите клетки от токсичных активных форм кислорода (АФК), обеспечивая регенерацию антиоксиданта глутатиона (GSH), что особенно важно для выживания раковых клеток в условиях метаболического стресса.
С другой стороны, NADPH необходим для синтеза жирных кислот и нуклеотидов, необходимых для поддержания роста и пролиферации клеток, что является неотъемлемой частью биологии опухолевой клетки. Зачастую рост раковой клетки ограничен уровнями NADPH, следовательно, изменения в метаболизме раковой клетки должны учитывать этот важный аспект.
Как связаны между собой окисление жирных кислот и производство NADPH? Основным продуктом окисления жиров является ацетил-КоА, который вступает в цикл Кребса и превращается в цитрат. Цитрат может остаться воволеченным в цикл Кребса, а может покинуть митохондрию и выйти в цитоплазму.
Там он превратится в изоцитрат, который является субстратом для NADP-зависимой изоцитратдегидрогеназы [13]. Этот фермент окисляет изоцитрат, при этом происходит перенос водорода на NADP+ и образуется NADPH, необходимый раковым клеткам. Например, в клетках глиомы, в которых ингибируется окисление жирных кислот, значительно понижается уровень NADPH, что приводит к накоплению АФК и, как следствие, клеточной гибели [14].
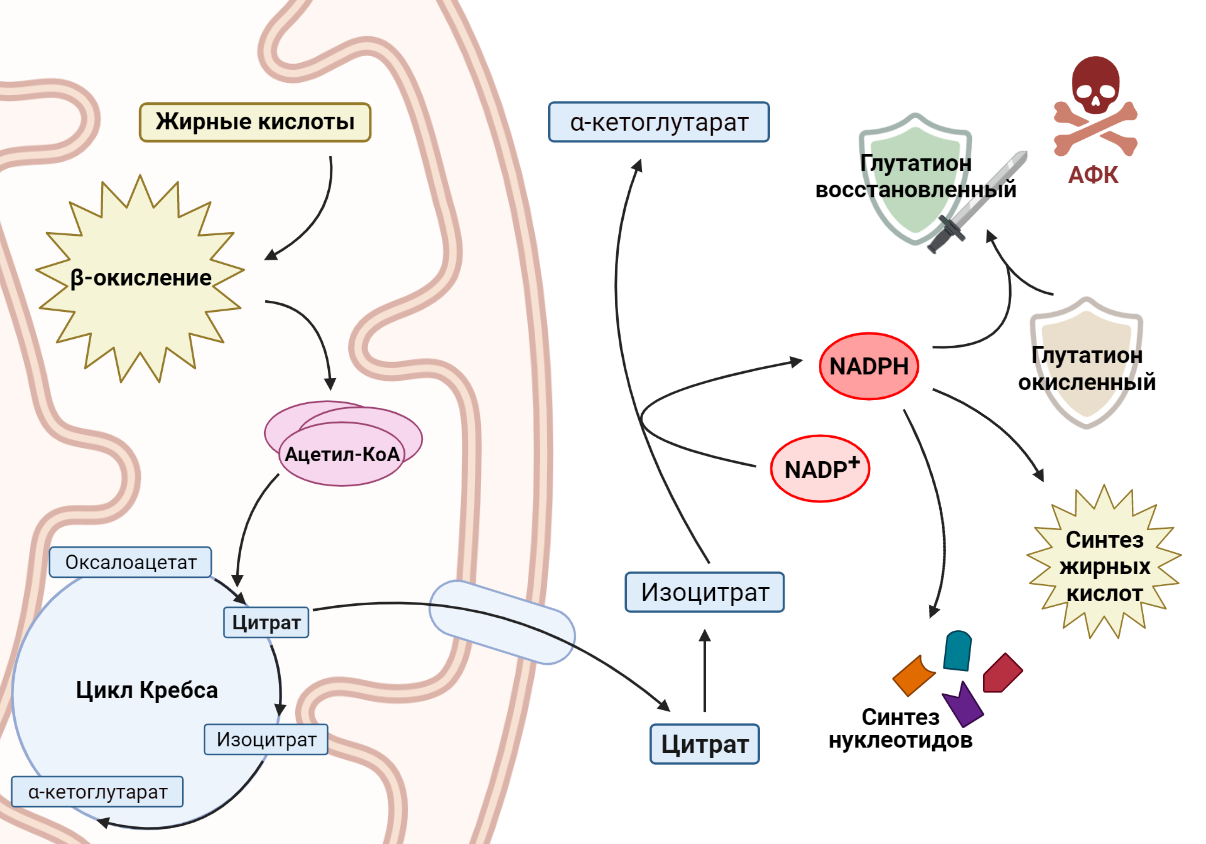
Рисунок 6. Ацетил-КоА, продукт окисления жирных кислот, поступает в цикл Кребса. В то же время цитрат, промежуточное соединение цикла Кребса, покидает митохондрию, где превращается в изоцитрат. При окислении изоцитрата происходит перенос водорода на NADP + , образуется NADPH, необходимый клеткам для множества процессов.
коллаж авторов статьи. Создан с помощью BioRender.com
Аминокислоты
Как известно, белки принимают участие в большинстве клеточных процессов: поддерживают форму клетки, обеспечивают ее подвижность, контролируют работу генов, регулируют метаболические процессы и многое-многое другое. Аминокислоты являются строительными мономерными блоками для белков. Удивительно, что при огромном разнообразии белков, все они построены из довольно ограниченного набора аминокислот (рис. 7).
Рисунок 7. 20 классических аминокислот.
С пищей в организм попадают белки, после чего в желудочно-кишечном тракте они деградируют до отдельных аминокислот. Смесь аминокислот всасывается в тонком кишечнике, поступает в кровь и разносится к каждой клетке организма. В клетках аминокислоты используются уже для синтеза собственных белков, которые необходимы для нормального функционирования организма.
Важно отметить, что некоторые из аминокислот клетки нашего организма умеют синтезировать сами (так называемые заменимые аминокислоты), а некоторые непременно должны поступать с пищей (незаменимые аминокислоты). Итак, аминокислоты, которые попали в клетку, могут войти в состав белков, но для нас более интересен тот факт, что отдельные аминокислоты могут выполнять специальные метаболические функции. Далее мы будем рассматривать роль конкретных аминокислот в метаболизме раковых клеток, а также возможные диетические стратегии для пациентов с онкологическими заболеваниями, основанные на ограничении или биодобавках данных аминокислот в рационе.
Метионин
Серин
Аминокислота серин принимает участие во множестве метаболических процессов: в синтезе нуклеотидов и липидов; она может превращаться в пируват и поступать в цикл Кребса, и так далее. Серин относится к заменимым аминокислотам и может синтезироваться в нормальных клетках из глюкозы и глицина (самой простой аминокислоты).
Для раковых клеток, которые активно используют гликолиз и, соответственно, остро нуждаются в глюкозе, синтез серина из глюкозы непременно обернется потерями в количестве АТФ и скорости размножения. Именно поэтому можно сказать, что для опухолевых клеток серин является незаменимой аминокислотой, то есть обязательно должен поступать извне. Путь синтеза серина из глицина для раковых клеток тоже крайне нежелателен, так как глицин принимает непосредственное участие в синтезе нуклеотидов, а значит, превращение глицина в серин опять же ставит под угрозу скорость деления раковых клеток. Таким образом, ограничение потребление серина действительно может помочь в терапии опухолей. Эффективность такой диеты уже была показана в экспериментах на мышах, но клинических исследований пока не проводилось [1].
Аргинин
В нормальных клетках аргинин способен образовываться de novo, то есть является заменимой аминокислотой. В опухолевых клетках меланомы, гепатоцеллюлярной карциномы и рака простаты синтез аргинина сильно снижен. Это связано с низким уровнем фермента аргининосукцинатсинтетазы, участвующем в образовании аргиинина. Выходит, что некоторые раковые опухоли требуют поступление аргинина извне (для клеток этих опухолей аргинин — незаменимая аминокислота). «Аргининовая зависимость» опухолей может быть использована для терапии, причем как в фармакологических подходах, так и в простом диетическом ограничении аргинина. Про фармакологическое снижение аргинина в раковых клетках уже кое-что известно из научных работ: так, например, препараты, снижающие уровень аргинина в плазме крови пациентов, оказались эффективными при лечении гепатоцеллюлярной карциномы и меланомы [19].
Однако аргинин может негативно сказываться на противоопухолевом иммунитете. Важнейшими клетками, участвующими в борьбе с опухолью, являются T-лимфоциты. Аргинин активно поглощается активированными T-клетками, затем метаболизируется, что приводит к увеличению выживаемости клеток и усилению противоопухолевого Т-клеточного ответа. В мышиной модели рака кожи увеличение количества потребляемого с пищей аргинина привело к уменьшению размера опухолей, способствовало выживанию мышей [20].
Не менее важную роль в противоопухолевом иммунитете играют NK-клетки (Natural killer cells, натуральные киллеры) — иммунные клетки, способные уничтожать опухолевые клетки. Исследования показали, что потребление аргинина с пищей увеличивает количество и активность NK-клеток [21], и, наоборот, дефицит аргинина угнетает работу и жизнеспособность натуральных киллеров [22], что может негативно сказаться на борьбе с опухолью.
Цистин и цистеин
Одна из важнейших функций аминокислоты цистеина в клетке — защита от активных форм кислорода (например, перекиси водорода), которые повреждают ДНК, липиды и белки, вызывая в клетке окислительный стресс. Раковые клетки, по сравнению с нормальными, испытывают сильный окислительный стресс и требуют большого количества цистеина.
Действительно, для некоторых опухолевых клеток снижение уровня цистеина губительно: клетки «сгорают» из-за накопленных активных форм кислорода. Цистеин образуется из неклассической аминокислоты цистина, которая поступает в клетку из плазмы крови [1]. Препараты, снижающие уровень цистина в плазме крови, тормозят рост опухолей с мутантным рецептором эпидермального фактора роста (например, немелкоклеточного рака легких) у мышей [23]. Теоретически, достичь снижения уровня цистина в плазме крови пациентов можно при помощи корректировки диеты, без применения препаратов, но такой подход пока не исследован.
Гистидин
При деградации гистидина в клетке тратится тетрагидрофолат — кофактор, который необходим для синтеза нуклеотидов, а значит, определяет скорость деления раковых клеток. Чем больше в раковую клетку поступает гистидина, тем больше тетрагидрофолата тратится на распад гистидина и тем медленнее клетка делится.
Применение гистидина вместе с пищей может помочь в терапии некоторых видов опухолей. В частности, такой диетический подход может стать особенно эффективным при лечении рака химиотерапевтическим агентом — метотрексатом (часто применяется для лечения злокачественных заболеваний крови). Метотрексат нарушает синтез тетрагидрофолата, что приводит к остановке синтеза нуклеотидов и к гибели раковых клеток. Оказалось, что эффективность лечения лейкемии метотрексатом заметно увеличивается при добавлении к пище аминокислоты гистидина — это было показано на мышиной модели [24].
Биодобавки фолиевой кислоты
В заключение мы хотим уделить внимание витаминам. Витамины необходимы для протекания многих биохимических реакций и должны поступать в организм с пищей. Существует распространенное заблуждение о том, что прием витаминных биодобавок может послужить защитой от рака и других заболеваний.
На самом деле, витамины должны поступать исключительно с пищей, а дополнительный прием витаминов здоровым людям в основном не рекомендован (за некоторыми редкими исключениями). Регулярный прием биодобавок может оказаться не только неэффективными, но и вредным, особенно людям, страдающим онкологическими заболеваниями. Давайте рассмотрим пример того, как дополнительный прием витаминов способствует росту опухоли.
Фолиевая кислота (фолат, витамин B9) является необходимым веществом для синтеза нуклеотидов. Опухолевые клетки быстро делятся и нуждаются в больших количествах нуклеотидов для синтеза ДНК, поэтому активно потребляют фолат. Еще в 1948 году стало известно, что биодобавки фолиевой кислоты способствуют росту некоторых видов опухолей [25]. На сегодняшний день метаболизм фолиевой кислоты является фармакологической мишенью для терапии рака: упоминавшийся ранее химиотерапевтический препарат метотрексат нарушает метаболизм фолата и ингибирует пути синтеза нуклеотидов. Надо подчеркнуть, что антифолиевая терапия рака пока что является сугубо фармакологической и не предполагает корректировки диеты [1].
Однако потенциальные негативные эффекты фолата в опухолевой прогрессии на этом не заканчиваются. Ряд исследований показал, что присутствие в крови неметаболизированной фолиевой кислоты, связанное с ее избыточным потреблением, влекло за собой снижение количества и активности NK-клеток [26-28]. Упоминавшиеся ранее NK-клетки — это иммунные клетки, одна из основных функций которых состоит в защите организма от раковых клеток. Следовательно, снижение числа и подавление активности NK-клеток может повлечь за собой повышенный риск образования и прогрессии рака, хотя конкретных исследований о влиянии высоких доз фолата на противоопухолевый иммунитет не проводилось.
Заключение
Мы постарались кратко охарактеризовать некоторые особенности метаболизма опухолевых клеток и роль питательных веществ в прогрессии рака. В заключение мы хотели бы еще раз обратить внимание на то, что не существует какой-либо универсальной диеты для людей, страдающих онкологическими заболеваниями. Это связано с тем, что опухоли сильно различаются по своему метаболизму.
Перечисленные диетические подходы пока что не могут использоваться повсеместно, так как перед внедрением любого из них для каждого типа рака, его локализации и стадии заболевания должны быть проведены масштабные клинические испытания, подтверждающие безопасность и эффективность нового метода лечения. Однако, ввиду многообещающих результатов исследований, модификации диеты являются перспективным подходом к лечению рака. Мы уверены, что в скором времени контроль состава диеты пациентов станет важной частью терапии онкологических заболеваний и поможет спасти многие жизни. А пока что давайте просто стараться питаться правильно и вести здоровый образ жизни. Будьте здоровы!
Источник: biomolecula.ru