Металлами называют кристаллические вещества с закономерным расположением атомов в узлах пространственной решетки, обладающие непрозрачностью, металлическим блеском и хорошей проводимостью тепла и электрического тока. Для металлов характерны также плотная кристаллическая структура, высокая прочность, способность к значительным пластическим деформациям, что дает возможность обрабатывать их давлением (прокатка, ковка, штамповка, волочение), хорошие литейные свойства, способность к образованию сплавов, свариваемость, выносливость (способность работать при низких и высоких температурах) и др. Наличие этих свойств и характеризует так называемое металлическое состояние вещества. Неметаллы не обладают вышеперечисленными свойствами и резко отличаются по внешнему виду от металлов.
Все металлы условно (исторически) подразделяются на две большие группы: черные и цветные (рис. 1). К черным металлам, имеющим темно-серый цвет, относятся железо и сплавы на его основе (сталь, чугун и ферросплавы). Все остальные металлы и сплавы составляют группу цветных (нежелезных) металлов. Характерной окраской для них является красная, желтая и белая.
Классификация опалубок
Из группы цветных металлов выделяют благородные и редкие. Благородные получили такое название из-за очень высоких физико-химических и механических свойств как в чистом виде, так и в виде соединений с другими металлами. К ним относят золото, серебро и платиновые металлы.
Признаками редкого металла в технике считается малая распространенность в природе, сложная технология получения, сравнительная новизна практического применения и др. Поэтому важнейшими отраслями их использования являются ядерная энергетика, ракетная техника, радиоэлектроника. К ним относят галлий, индий, бериллий, цезий и др.
Различают технически чистые металлы и сплавы. Чистые металлы состоят из одного основного элемента и незначительного количества примесей других элементов. По степени чистоты различают металлы технической, высокой и особой чистоты. Однако чистые металлы находят ограниченное применение как в строительстве, так и в машиностроении.
В большинстве случаев они обладают недостаточно высокими физическими, механическими и химическими свойствами, имеют сравнительно высокую стоимость, достаточно сложную технологию получения и переработки и мало пригодны для технических целей. Их используют, как правило, только в тех случаях, когда к материалу предъявляются высокие требования в отношении тепло- и электропроводности, высокой температуры плавления и т.п, например для изготовления проводов, кабелей, обмоток электрических машин и др.
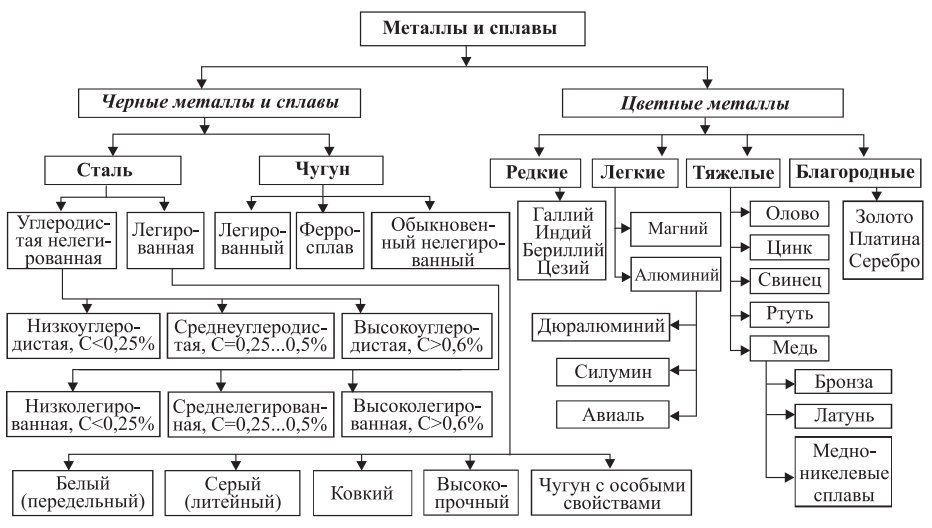
Рис. 1. Классификация металлов и сплавов
Для изменения свойств металлов в требуемом направлении их сплавляют с другими элементами. Такие соединения или системы, состоящие из двух или нескольких металлов или металлов и некоторых неметаллов, называют сплавами, а элементы, входящие в их состав, – компонентами. К последним относятся как химические элементы, так и устойчивые химические соединения. В настоящее время известно более 10 тыс. используемых в промышленности сплавов. Например, латунь – сплав двух металлов (меди с цинком), бронза – сплав меди с оловом или другими элементами, сталь и чугун – сплавы железа с углеродом, кремнием, марганцем, фосфором и серой.
Лекция иссо: Металлические мосты, классификация и устройство
По числу компонентов сплавы делятся на двухкомпонентные (двойные, или бинарные), трехкомпонентные (тройные) и многокомпонентные. Компонент, преобладающий в сплаве количественно, называется основным, а компоненты, вводимые в сплав для придания ему нужных свойств, – легирующими. Совокупность компонентов сплава называется системой. Изменяя компоненты и соотношения между ними, получают сплавы с самыми разнообразными физическими, механическими или химическими свойствами.
Сплавы обладают всеми характерными свойствами металлов, однако качественные характеристики их обычно резко отличаются от чистых исходных металлов и их можно регулировать. Например, сплав, содержащий 40% кадмия и 60% висмута, имеет температуру плавления 144 °С, а температура плавления составляющих его компонентов – соответственно 321 °С и 271 °С, т.е. намного выше. Сплавы, как правило, превосходят чистые металлы по прочности, твердости, износостойкости, жаропрочности, обрабатываемости резанием, литейным свойствам и т.д. Поэтому они применяются значительно шире чистых металлов. Однако в технике как чистые металлы, так и сплавы объединены под общим термином «металлы».
2. Строение металлов
Внутреннее строение металлов. Поскольку металлы в твердом состоянии в отличие от аморфных веществ имеют кристаллическое внутреннее строение, то образующие их элементарные частицы (атомы) в процессе кристаллизации из расплавленного (жидкого) состояния группируются в строго определенной последовательности. Для описания такого строения французским ученым О. Браве (Auguste Bravais) было введено понятие кристаллической (пространственной) решетки, т.е. математической системы точек в пространстве. Условно кристаллическая решетка представляет собой элемент объема, образованный минимальным количеством атомов, многократное повторение которого в пространстве позволяет построить весь кристалл.
Всего существует 14 различных типов кристаллических решеток. Металлы преимущественно кристаллизуются в одном из трех типов структур: объемно центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ). Для изображения кристаллической решетки пользуются упрощенными схемами (рис. 2).
В объемно центрированной кубической решетке содержится девять атомов: восемь расположены в вершинах куба и один – в центре объема (рис. 2, а). Такую решетку имеют молибден, вольфрам, ванадий и др.
В гранецентрированной кубической решетке находится четырнадцать атомов, которые расположены в вершинах куба и в центре каждой грани (рис. 2, б). Такая кристаллическая решетка характерна для железа, никеля, меди, алюминия, свинца, золота, серебра и др.
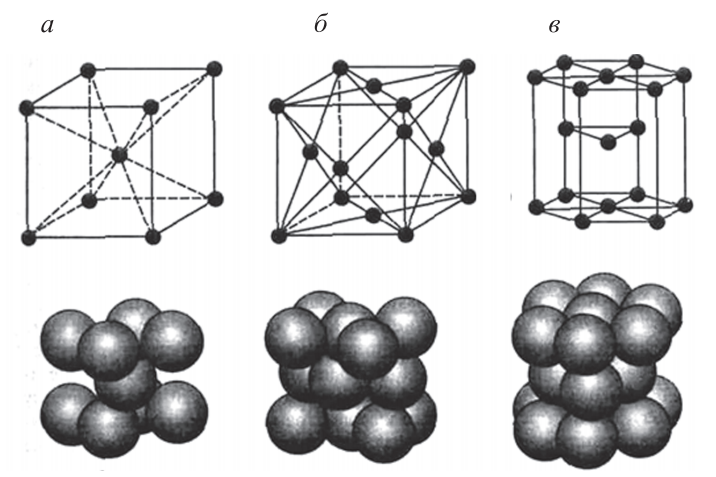
Рис. 2. Основные типы кристаллических решеток и схемы упаковки в них атомов: а – объемно центрированная кубическая; б – гранецентрированная кубическая; в – гексагональная плотноупакованная
В гексагональной плотноупакованной решетке содержится семнадцать атомов, которые расположены в вершинах и центре шестигранных оснований призмы, и три атома – в средней плоскости призмы (рис. 2, в). Такой тип кристаллической решетки имеют магний, цинк, кадмий, альфа-цирконий и др.
При этом линии на схемах и точечное расположение атомов в узлах кристаллической решетки являются условными. В действительности атомы имеют определенные размеры, колеблются с большой частотой в узлах решетки и могут соприкасаться друг с другом внешними слоями электронных оболочек (см. рис. 2). Основными параметрами кристаллической решетки являются период, коэффициент компактности, координационное число и базис.
Полиморфизм (аллотропия) металлов. Сущность полиморфизма (от греч. рolymorphos – многообразный) состоит в том, что под влиянием определенных процессов (изменение температуры, давления) некоторые вещества, в том числе и ряд металлов, способны изменять свою кристаллическую решетку при сохранении химического состава.
С физической точки зрения превращение металла из одной формы в другую обусловливается внутренней перегруппировкой молекул, которая ведет к изменению его кристаллической структуры и свойств. При этом различные формы кристаллической решетки одного металла называют полиморфными модификациями. Каждой модификации свойственно оставаться устойчивой лишь в границах определенного для данного металла интервала температур. Температура, при которой происходит превращение одной кристаллической модификации в другую, называется температурой полиморфного превращения.
Полиморфизм характерен для железа, олова, кобальта, титана и некоторых других металлов. Медь, алюминий не претерпевают полиморфных превращений. Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз. Например, кобальт при разных температурах может иметь гранецентрированную или гексагональную кристаллическую решетку, железо – объемно центрированную или гранецентрированную кубическую решетку.
Низкотемпературную модификацию железа называют α-, при более высокой – β-, затем – γ-модификацией. Температуры перехода одной модификации железа в другую (911 °С и 1392 °С) называются критическими точками. При этом углерод, другие компоненты и примеси меняют положение критических точек на температурной шкале.
В результате полиморфного превращения образуются новые кристаллические зерна, имеющие другой размер и форму. Поэтому такое превращение называют еще перекристаллизацией, и сопровождается оно скачкообразным изменением всех свойств металлов и сплавов: плотности, теплоемкости, тепло- и электропроводности, прочности и др. На практике полиморфизм используется в технологическом процессе при термической обработке металлов.
3. Общие сведения о железоуглеродистых сплавах
Кроме того, чистое железо в природе, за исключением метеоритного, практически не встречается. Это объясняется способностью железа сравнительно легко соединяться с другими элементами, особенно с кислородом. В природе железо чаще всего встречается в составе железных руд в виде оксидов (Fe3O4, Fe2О3, 2Fe2O3 · 3H2O) и других соединений. После извлечения железа из руд оно содержит в своем составе определенное количество углерода и немного примесей (сопутствующих металлов и газов). Соединения железа с углеродом называют железоуглеродистыми сплавами.
Таким образом, то, что в обиходе называют железом, является сплавом железа с углеродом в виде стали или чугуна, представляющих собой важнейшие материалы в различных отраслях промышленности. Сплавы, содержащие 0…0,02% углерода, называются техническим железом, 0,02…2,14% – сталями, 2,14…6,67% – чугунами. Свойства железоуглеродистых сплавов, их назначение и способы обработки определяются количеством углерода.
Фазовые и структурные составляющие железоуглеродистых сплавов. В зависимости от температуры и концентрации углерода железоуглеродистые сплавы имеют следующие фазы: жидкий раствор, твердые растворы (феррит и аустенит), химическое соединение (цементит) и тонкие механические смеси фаз – эвтектическая (ледебурит) и эвтектоидная (перлит).
Феррит (от лат. ferrum – железо) – твердый раствор внедрения углерода (и других примесей, например Mn, Si) в α-железе. Имеет объемно центрированную кубическую решетку. Растворимость углерода в α-железе весьма мала. При комнатной температуре она составляет не более 0,005%, максимальная (при температуре 727 °С) – 0,02%.
Поэтому феррит представляет собой почти чистое железо, но отличается от него тем, что в его кристаллической решетке кроме атомов железа имеется небольшое количество атомов углерода и других примесей. Феррит характеризуется низкими твердостью (80…100 НВ) и прочностью (σ = 250 МПа), но высокой пластичностью (δ = 40…50%) и ударной вязкостью. Чем больше феррита в сплавах, тем они мягче и пластичнее. Феррит хорошо поддается обработке давлением в холодном состоянии (волочению, штамповке).
Аустенит (по имени английского ученого У. Роберса-Остена – W. Roberts-Austen) – твердый раствор внедрения углерода (и других элементов) в γ-железе. В железоуглеродистых сплавах может существовать только при высоких температурах. Предельная растворимость углерода в γ-железе при температуре 1147 °С – 2,14% (точка Е на рис. 3 и в табл.
1) и минимальная (0,8%) при температуре 727 °С (точка S). При нормальной температуре (18…24 °С) аустенит в простых железоуглеродистых сплавах отсутствует и его нельзя увидеть. Кристаллическая решетка аустенита – гранецентрированный куб. Аустенит характеризуется достаточно высокой пластичностью (δ = 40…50%) и сравнительно низкой твердостью (160…200 НВ), но более высокой, чем у графита. Хорошо поддается горячей обработке давлением.
Цементит – химическое соединение железа с углеродом (карбид железа Fe3C) при содержании железа 93,33% и углерода – 6,67%. Назван так за высокую твердость (легко царапает стекло). Эта самая твердая (более 800 НВ) и хрупкая составляющая железоуглеродистых сплавов. Пластичность практически нулевая.
Чем больше цементита в железоуглеродистых сплавах, тем большей твердостью и меньшей пластичностью они обладают. Температура плавления цементита – около 1600 °С. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Перлит (от фр.
perle – жемчуг, указывает на перламутровый отлив шлифа) – механическая смесь феррита и цементита, содержащая 0,83% углерода. Является продуктом распада аустенита в процессе его охлаждения при 727 °С. Распад аустенита на перлит называется эвтектоидным превращением, а перлит – эвтектоидом (от эвтектика и греч.
eidos – вид) – аналогичная эвтектике структурная составляющая металлических сплавов, но в отличие от нее образуется не из жидкой, а из твердой фазы и поэтому имеет более тонкое внутреннее строение из двух и более фаз (перлит). Эвтектика (от греч. eutektos – легко плавящаяся) – тонкая смесь твердых веществ, одновременно начинающихся кристаллизоваться из расплавов при температуре менее температуры плавления отдельных компонентов или любых других смесей.
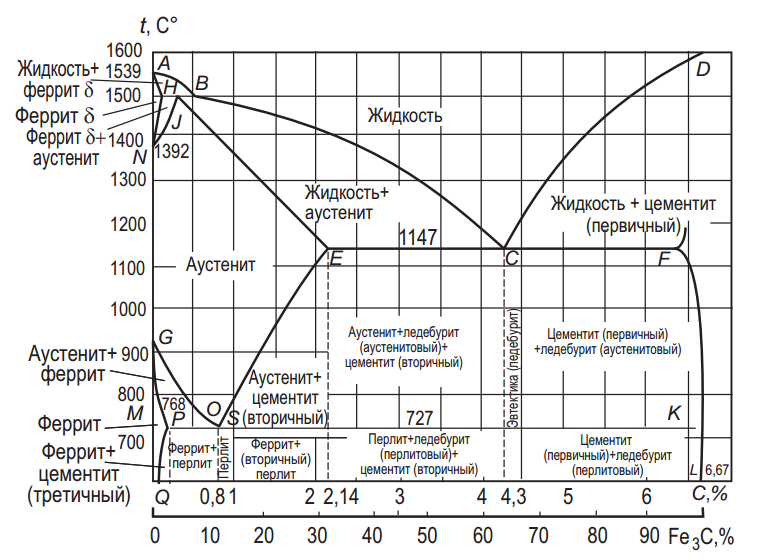
Рис. 3. Диаграмма состояния железоуглеродистых сплавов
Ледебурит (по имени немецкого ученого А. Ледебура) – механическая смесь (эвтектика) аустенита и цементита, содержащая 2…6,67% углерода. Образуется во время кристаллизации расплава при температуре 1147 °С. При температуре 727 °С аустенит превращается в перлит, и после охлаждения ледебурит представляет собой смесь перлита с цементитом. Ледебурит обладает большой хрупкостью и высокой твердостью (600…700 НВ), хорошими литейными свойствами. Содержится во всех высокоуглеродистых сплавах, называемых белыми чугунами.
Cталь, содержащая 0,83% углерода, называется эвтектоидной (состоит из перлита). Если в стали углерода менее 0,83%, то ее называют доэвтектоидной (из феррита и перлита), а при содержании углерода более 0,83%, но не более 2,14% – заэвтектоидной (из перлита и вторичного цементита).
Чугун, содержащий углерода больше 2,14%, но меньше 4,3%, называют доэвтектическим (имеет структуру перлита, ледебурита (распавшегося) и вторичного цементита. При содержании углерода 4,3% чугун называют эвтектическим (состоит только из ледебурита), а при содержании углерода более 4,3%, но менее 6,67% – заэвтектическим (из первичного цементита, имеющего форму пластин, и ледебурита (распавшегося)).
Помимо перечисленных структурных составляющих в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: оксиды, нитриды, сульфиды, фосфиды и др.
Диаграмма состояния железоуглеродистых сплавов. Диаграммы состояния представляют собой графические изображения фазового состава сплавов в зависимости от температуры и концентрации химических компонентов в условиях равновесия. Строятся они в координатах температура – состав сплава.
Диаграмма состояния железоуглеродистых сплавов может быть представлена в двух вариантах: метастабильном, отражающем превращения в системе железо – карбид железа, и стабильном, отражающем превращения в системе железо – графит. Наибольшее практическое значение имеет диаграмма состояния железо – карбид железа, так как для большинства технических сплавов превращения реализуются по этой диаграмме. Карбид железа (Fe3C) называют цементитом, поэтому метастабильную диаграмму железоуглеродистых сплавов называют еще диаграммой состояния железо – цементит (Fe – Fe3C).
Зная диаграмму состояния, можно представить полную картину формирования структуры любого сплава, определять оптимальную температуру жидкого расплава перед разливкой, оценить жидкотекучесть сплава и склонность его к получению химической неоднородности, делать выводы о способности сплава пластически деформироваться, т.е. о возможности и условиях обработки давлением, определять режимы термической обработки.
Линия диаграммы АВСD называется линией ликвидус (от лат. liqvidus – жидкий) и является линией начала кристаллизации сплава. Выше этой линии все сплавы находятся в жидком состоянии и диаграмма состоит из трех частей. Соответственно на участках АВ из жидкого раствора начинает кристаллизоваться феррит, ВС – аустенит и СD – первичный цементит.
Точка А на диаграмме соответствует температуре плавления (затвердевания) железа (1539 °С), точка D – температура плавления (затвердевания) цементита (~ 1600 °С), точки N (1392 °С) и G (911 °С) соответствуют полиморфному превращению Feα x Feγ (табл. 1).
Таблица 1. Основные точки диаграммы «железо – углерод»
Железо с температурой плавления 1539 °С имеет две модификации – α и γ. Модификация Feα существует при температурах до 911 °С и в пределах 1392…1539 °С, модификация Feγ – в интервале температур 911…1392 °С.
Линия АНJЕСF, на которой кристаллизация завершается, называется линией солидус (от лат. solidus – твердый). Она характеризует конец первичной кристаллизации, является началом вторичной кристаллизации (перекристаллизации) и характерна для твердой фазы. Между линиями солидус и ликвидус идет процесс кристаллизации, и сплавы состоят из жидкой и твердой фаз.
Ниже линии солидус все сплавы данной системы находятся в твердом состоянии. Линия AH – граница области, соответствующей смеси кристаллов феррита и жидкости, ниже ее – область феррита. Линия HJB – линия превращения феррита и жидкого сплава в аустенит. На участке линии ЕСF при температуре 1147 °С и содержании углерода 4,3% из жидкого сплава одновременно кристаллизуются аустенит и цементит (первичный), образуя эвтектику – ледебурит.
Линия GSE диаграммы называется линией верхних критических точек или линией начала превращения аустенита (при охлаждении). Точка G соответствует температуре (911 °С) перехода чистого железа из модификации γ-железа в α-железо. При температурах, лежащих на линии GS, начинается выделение феррита из аустенита.
Линия PSK диаграммы (t = 727 °С) называется линией нижних критических точек или линией перлитного превращения (при охлаждении). Точки H и P характеризуют предельную концентрацию углерода соответственно в высокотемпературном и низкотемпературном феррите. Точка E определяет наибольшую концентрацию углерода в аустените.
Линии ES и PQ характеризуют изменение концентрации углерода в аустените и феррите соответственно. В точке S, соответствующей содержанию углерода 0,8%, при температуре 727 °С аустенит полностью распадается, образуется перлит.
На диаграмме имеется также три горизонтали (HB, EF и PS) трехфазных равновесий: соответственно перитектического (t = 1496 °С), эвтектического (t = 1147 °С) и эвтектоидного (t = 727 °С).
4. Чугун
Производство чугуна. Получение чугуна заключается в восстановлении железа из оксидов железной руды. Процесс получения чугуна ведут преимущественно в доменных печах. Существуют также и внедоменные способы получения чугуна, т.е. по прямому восстановлению из руд. Однако они не получили еще широкого внедрения.
Для доменного чугуна в качестве железных руд используют магнитный железняк (магнетит), красный железняк (гематит), бурый железняк (гетит) и шпатовый железняк (сидерит), содержащие 30…70% железа в виде оксидов Fe2O3 или Fe3O4. В состав пустой породы входят оксиды кремния SiO2 (кремнезем), алюминия Аl2O3 (глинозем), кальция СаО, магния МgO и другие составляющие.
Флюсы предназначены для понижения температуры плавления, обеспечения плавки руды и связывания пустой породы, неизбежно остающейся в руде после процесса рудоподготовки. По химическому составу различают основные флюсы (известняк, доломит), кислые (кремнезем) и нейтральные (глинозем). Они сплавляются с пустой породой и золой топлива и образуют легкоплавкий сплав-шлак, не смешивающийся с жидким чугуном.
Основным видом топлива в доменном процессе служит кокс, но в отдельных случаях в дополнение к коксу используют природный газ или пылевидный каменный уголь. Топливо при выплавке чугуна является не только источником тепла, но и принимает участие в окислительно-восстановительных реакциях, протекающих в процессе плавки. Оно является так же и основным источником углерода.
Доменная печь (домна) относится к разряду шахтных и работает по принципу противотока. Внутри она выложена огнеупорным материалом (шамотным кирпичом, блоками), сверху покрыта стальным кожухом. По химическому составу огнеупоры могут быть кислые (динас), основные (доломит, магнезит) и нейтральные (шамот). Современные доменные печи имеют общую высоту 80 м и объем рабочего пространства до 5600 м 3 . Производительность доменной печи объемом 3000 м 3 составляет более 6000 т чугуна в сутки.
Технологический процесс производства чугуна автоматизирован. Шихту непрерывно подают через загрузочные устройства в верхнюю часть печи, а снизу через фурмы вдувают горячий воздух. В условиях доменной печи при температуре 1900 °С происходит интенсивное насыщение железа углеродом (науглероживание), поэтому доменный чугун обычно содержит 2…4,6% углерода.
Флюсы взаимодействуют с компонентами руды, образуя шлак, в который уходят вредные примеси (сера, фосфор), пустая порода, излишки марганца и некоторые цветные металлы. Доменные газы выпускаются через колошники в верхней части печи. Расплавленный чугун стекает в низ печи, а расплавленный шлак как более легкий находится сверху чугуна, предохраняя его от окисления.
Жидкий чугун выпускается через нижнюю летку, шлаки – через верхнюю. В доменных печах получают жидкий передельный и литейный чугуны, доменные ферросплавы (специальные чугуны), шлак и доменные газы. Чугун является основным и главным продуктом доменного производства, а шлак и доменные газы – побочными.
Разновидности чугуна. Передельный чугун (ГОСТ 805) содержит 4…4,5% углерода, 0,6…0,8% кремния, 0,25…1,0% марганца, до 0,07% серы и до 0,3% фосфора. В его структуре преобладает цементит – твердое и хрупкое соединение. Передельный чугун выпускается трех типов:
- для сталеплавильного (марки П1 и П2) и литейного (ПЛ1 и ПЛ2) производства;
- фосфористый (ПФ1, ПФ2 и ПФ3);
- высококачественный (ПВК1, ПВК2 и ПВК3).
На долю передельного чугуна приходится до 90% всей продукции доменных печей.
Белыми называют передельные чугуны, в которых весь углерод находится в связанном состоянии в виде цементита. В изломе они имеют матово-белый цвет и характерный металлический блеск. Получают при быстром охлаждении расплава. Из-за большого содержания цементита белые чугуны обладают высокой твердостью (450…550 НВ), износостойкостью, хрупкостью, но плохо обрабатываются.
Поэтому для изготовления изделий они не используются. Применяются, как и передельный чугун, для производства стали или для отливки деталей с последующим отжигом на ковкий чугун.
Серыми называют литейные чугуны с пластинчатой формой графита, в изломе имеющие серый цвет. Содержание углерода в связанном состоянии составляет не более 0,5%. Механические свойства серого чугуна (ГОСТ 1412, EN 1561) определяются в основном количеством, формой и размерами графитных включений. По сравнению с металлической основой они имеют более низкую прочность.
Поэтому графитные включения можно считать нарушениями сплошности, ослабляющими металлическую основу. Чем меньше графитовых включений и выше их дисперсность, тем больше прочность чугуна.
Серый чугун менее твердый, чем передельный, хорошо обрабатывается режущими инструментами, имеет высокую износостойкость, но меньшую прочность. В случае предварительного подогрева может свариваться, обладает хорошими литейными свойствами.
Условное обозначение марки серого чугуна включает буквы СЧ (серый чугун) и цифровое обозначение величины минимального временного сопротивления при растяжении (МПа · 10–1). Например, марка СЧ 15 указывает, что минимальное временное сопротивление при растяжении серого чугуна составляет 150 МПа. В строительстве серый чугун применяют главным образом для изготовления изделий, работающих при сжатии (башмаки, тюбинги, колонны в санитарно-технических системах), и в архитектурно-художественном оформлении.
Модифицированные серые чугуны получают при добавлении в жидкий чугун перед разливкой специальных добавок (ферросилиция, силикокальция и др.). Они имеют более однородное строение по сечению отливки и мелкую завихренную форму графита. Обладают повышенными механическими и литейными свойствами.
Высокопрочные чугуны (ГОСТ 7293, EN 1563) являются разновидностью серых, но из-за повышенных механических свойств их выделили в особую группу. Получают при модифицировании жидкого серого чугуна магнием или церием (0,03…0,07% от массы отливки). В результате модифицирования частицы графита находятся в чугуне в виде маленьких сфер (шариков), исключая образование и распространение трещин. Помимо высокой прочности такой чугун обладает еще и высокой пластичностью.
Условное обозначение марки высокопрочного чугуна включает буквы ВЧ (высокопрочный чугун) и цифровое обозначение величин предела прочности при растяжении (МПа · 10–1) и в ряде случаев – относительного удлинения (%). Например, марка ВЧ 100-2 указывает, что предел прочности при растяжении высокопрочного чугуна составляет 1000 МПа при относительном удлинении 2%.
Высокопрочные чугуны применяются в различных отраслях техники, эффективно заменяя сталь во многих изделиях и конструкциях. Из них изготовляют трубы, оборудование прокатных станов, кузнечно-прессовое оборудование, корпуса паровых турбин, коленчатые валы и другие детали, работающие при циклических нагрузках и в условиях сильного износа.
5. Сталь
Общие сведения. Сталь (польск. Stal, нем. Stahl) – это деформируемый (ковкий) сплав железа с углеродом и другими неизбежными (кремний, сера, фосфор) и скрытыми (кислород, водород, азот) примесями. Она занимает левую часть диаграммы состояния железоуглеродистых сплавов (см. рис. 3). Доля железа в сплаве составляет 90…98,5%, а доля углерода не превышает 2,14%.
Кроме того, в состав стали входят и другие химические элементы, либо содержащиеся в руде (кремний, марганец, фосфор, сера), либо вводимые специально для улучшения (легирования) свойств (никель, ванадий, хром, молибден). В сравнении с чугуном сталь обладает лучшими механическими свойствами, что обусловлено меньшей концентрацией в ней углерода и нормальных примесей.
Полученную в сталеплавильных агрегатах сталь выпускают в разливочный ковш, а затем либо разливают в металлические формы (изложницы), либо направляют на установки непрерывной разливки стали (машины непрерывного литья). Незначительная часть стали идет на фасонное литье. В результате затвердевания металла получаются стальные слитки или заготовки, которые в дальнейшем подвергают обработке давлением (прокатке, ковке). Технология и организация разливки является весьма ответственным этапом в общем производстве стали и в значительной мере определяет ее качество и количество отходов при последующем переделе стальных слитков.
Классификация сталей. По сложившейся практике стали классифицируют главным образом по химическому составу, способу производства, качеству, назначению, структуре в равновесном состоянии, степени раскисления, методам придания формы стальным изделиям и другим показателям. Единой международной классификации сталей не разработано.
В зависимости от химического состава стали делятся на углеродистые и легированные. По способу производства – на мартеновскую, электросталь (выплавленную в электродуговых печах), конверторную (выплавленную в кислородно-конверторных печах), сталь особых методов выплавки и др. При этом различают основную и кислую стали в зависимости от характера футеровки печи.
По качеству стали бывают:
По структуре сталь может быть перлитная, аустенитная, ферритная, мартенситная, карбидная.
Поведение металла при кристаллизации обусловлено степенью его раскисленности. Раскисление – это процесс удаления из жидкого металла кислорода, находящегося в виде оксида FeO и способствующего хрупкому разрушению при горячей деформации. Чем полнее удален из стали кислород, тем спокойнее протекает процесс затвердевания.
В зависимости от условий и степени раскисления стали могут быть кипящие (кп), полуспокойные (пс) и спокойные (сп). Каждый из этих видов стали имеет свои достоинства и недостатки. Выбор технологии раскисления и разливки стали определяется ее назначением и технико-экономическими показателями производства.
Исходя из механических характеристик различают стали обычной прочности (σв ≤ 420 МПа), повышенной прочности (420 < σв ≤ 550 МПа) и высокой прочности (σв > 550 МПа).
По назначению стали подразделяют на конструкционные (строительные и машиностроительные), инструментальные (углеродистые и легированные) и стали с особыми свойствами.
Разновидности сталей. Металлургической промышленностью разных стран вырабатывается более 2 тыс. различных марок сталей и сплавов на основе железа. На долю углеродистых сталей приходится около 80% от общего объема выплавки.
В сталях всегда присутствуют примеси, которые подразделяются на постоянные, или обычные (кремний, марганец, сера и фосфор), скрытые (газы в виде кислорода, азота и водорода), специальные (легирующие) и случайные. Наличие примесей в стали объясняется технологическими особенностями ее производства и невозможностью полного их удаления.
Легированными сталями называют те, в которые для получения требуемых свойств вводят специальные (легирующие) добавки других элементов, чаще всего металлов (никель, хром, молибден, вольфрам, медь и др.). Такие стали обладают более высоким уровнем механических и технологических свойств. Легирующие добавки оказывают различное влияние как на кристаллическое строение, так и физико-механические характеристики стали. Почти все легирующие добавки изменяют температуру полиморфных превращений железа, эвтектоидной и эвтектической реакций и влияют на растворимость углерода в аустените.
По степени легирования (т.е. по суммарному содержанию легирующих элементов) различают низколегированные (менее 2%), среднелегированные (2…10%) и высоколегированные (более 10%) стали. Низколегированные конструкционные стали являются переходными между углеродистыми и легированными. Такого вида сталь обладает по сравнению с углеродистой повышенной прочностью, износостойкостью и коррозионной стойкостью в различных средах, пониженной склонностью к старению, хорошей свариваемостью. В зависимости от количества легирующих элементов стали могут быть трехкомпонентные (железо, углерод и легирующий элемент), четырехкомпонентные (железо, углерод и два легирующих элемента) и т.д.
По наличию основных легирующих элементов сталь подразделяется на группы: хромистая, марганцевая, хромоникелевая, хромокремнистая и др.
Легированная конструкционная сталь (ГОСТ 4543) в зависимости от химического состава и свойств делится на качественную, высококачественную (А) и особовысококачественную (Ш). По видам обработки при поставке различают сталь горячекатаную, кованую, калиброванную, серебрянку.
Стали, используемые для изготовления металлических конструкций в сооружениях промышленных зданий, пролетных строений мостов и эстакад, магистральных нефте- и газопроводов называют строительными. Для этих целей используют в основном низколегированные (Si, Mn, Cr и др.) и углеродистые (0,10…0,25%) стали обыкновенного качества (ГОСТ 380). Поставляют их, как правило, по механическим свойствам в виде листов разной толщины и сортового проката (ГОСТ 535). Основными свойствами их являются механические (прочность, относительное удлинение) и технологические (свариваемость). Низколегированные строительные стали имеют улучшенные механические свойства и пониженную температуру перехода в хрупкое состояние (– 40 °С…–60 °С).
6. Термическая обработка металлов
Сущность термической обработки. Свойства металлов в значительной степени определяются его составом и внутренним строением (микроструктурой). Основным способом изменения структуры, а следовательно, и свойства металлов является их термическая обработка. Например, путем термической обработки стали можно придать ей различные, иногда совершенно противоположные свойства: сделать стальное изделие хрупким и твердым или, наоборот, мягким и пластичным.
Под процессом термической обработки понимается изменение внутреннего строения металла под воздействием изменяющихся температурных условий и, как следствие этого, получение определенных (заданных) физико-механических свойств металла. Параметрами термической обработки являются нагрев до определенной температуры (выше или ниже температуры фазовых превращений), выдержка при этой температуре, скорость нагрева и скорость охлаждения.
Нагрев, выдержку и охлаждение производят за определенное время. При нагреве и охлаждении в металлах (железоуглеродистых сплавах) происходят фазовые превращения при определенных температурах, называемых критическими точками (см. табл. 1 и рис. 3). Превращения носят кристаллизационный характер, т.е. происходит образование центров зародышей и последовательный их рост (перекристаллизация).
Температура нагрева выбирается в зависимости от химического состава сплава и цели производимой обработки. Она определяет характер происходящих в сплаве превращений и возможность получения требуемой структуры.
Время (скорость) нагрева должны обеспечить минимальные потери времени на нагрев и исключить возникновение в обрабатываемой детали опасных термических напряжений, которые могут привести к короблению и растрескиванию детали. Чем сложнее сталь по химическому составу, тем меньше должна быть скорость нагрева, так как легирующие элементы значительно понижают теплопроводность железа.
Время выдержки при температуре нагрева необходимо для завершения процессов фазовых и структурных превращений по всему объему изделий и составляет примерно 1/4…1/5 времени нагрева.
Скорость охлаждения должна быть достаточной для протекания в сплаве необходимых превращений, но в то же время не слишком большой во избежание опасных термических и фазовых напряжений, которые тоже могут вызвать растрескивание или коробление деталей.
По технологическим параметрам и фазовым превращениям различают три основные группы термической обработки металлов:
- собственно термическую – включающую в зависимости от структурного состояния, получаемого в результате ее применения, отжиг, закалку, отпуск и старение;
- химико-термическую – процесс изменения химического состава, микроструктуры и свойств поверхностного слоя металлов под действием высоких температур и в химически активной среде;
- термомеханическую – сочетание пластической деформации (прокатка, ковка, штамповка) с последующей закалкой и низкотемпературным отпуском.
В результате формирование структуры и свойств материала происходит в условиях повышенной плотности и оптимального распределения несовершенств строения, созданных пластической деформацией.
7. Цветные металлы и сплавы
Различают легкие цветные металлы (плотность до 3 г/см 3 – магний, алюминий, бериллий) и тяжелые (медь, свинец, олово, никель). Из группы цветных металлов выделяют также легкоплавкие (олово, свинец, цинк, кадмий, висмут) и тугоплавкие (хром, титан, молибден и др.). Легкоплавкие используют для приготовления припоев различных составов и назначения, тугоплавкие – в качестве легирующих добавок.
Применяют цветные металлы главным образом в виде сплавов, так как в чистом виде они обладают недостаточной прочностью. Наибольшее распространение из них получили сплавы на основе алюминия, меди, титана, олова, магния и других металлов.
Алюминий. Основным сырьем для промышленного производства алюминия служат бокситы и нефелины. Процесс получения алюминия является довольно сложным, энергоемким и включает получение из бокситов вначале глинозема (Аl2O3), а затем восстановление из раствора глинозема электролизом в расплавленном криолите (Na3AlF6) металлического алюминия.
Образующийся в результате электролиза жидкий алюминий собирается на дне ванны под слоем электролита. Его называют алюминиемсырцом. Он содержит в своем составе металлические и неметаллические примеси, а также газы, поэтому алюминий-сырец рафинируют. После рафинирования образуется технически чистый алюминий (ГОСТ 11069).
В зависимости от содержания примесей алюминий подразделяется на группы и марки:
В качестве примесей в алюминии могут присутствовать Fe, Si, Cu, Mn, Zn и др. Примеси оказывают существенное влияние на электрические и технологические свойства алюминия, его коррозионную стойкость.
Алюминий представляет собой серебристо-белый легкий металл с высокой тепло- и электропроводностью, хорошей коррозионной стойкостью в атмосфере и во многих агрессивных средах. По электропроводности он занимает третье место после серебра и меди. Чем чище алюминий, тем выше его электропроводность и коррозионная стойкость. На воздухе алюминий покрывается тонкой прочной беспористой пленкой оксида алюминия (Аl2O3) толщиной примерно 10 нм, защищающей металл от дальнейшего окисления и обусловливающей его высокую коррозионную стойкость. Однако в щелочных средах и некоторых неорганических кислотах алюминий быстро разрушается.
Алюминий обладает высокой технологической пластичностью, сваривается, полируется, но относительно плохо обрабатывается резанием из-за высокой вязкости и налипания металла на инструмент. Вместе с тем он хорошо обрабатывается давлением, поэтому применяется для изготовления тонких листов, проката, в том числе и фольги различного назначения. При холодной пластической деформации (прокатка, волочение) в результате наклепа получают твердый алюминий (АТ), который имеет повышенные механические характеристики (прочность, твердость), но при этом снижается относительное удлинение.
Чистый алюминий используют в производстве разного рода зеркал, отражателей, высокой чистоты – для предохранения металлических поверхностей от действия атмосферной коррозии (плакирование, алюминиевая краска), а также в качестве конструкционного материала в ядерных реакторах. В алюминиевых резервуарах большой емкости хранят и транспортируют жидкие газы (метан, кислород, водород), азотную и уксусную кислоты, чистую воду, перекись водорода и пищевые масла.
Общая характеристика алюминиевых сплавов. Поскольку технически чистый алюминий имеет невысокие прочностные показатели применение его в строительных конструкциях весьма ограничено. Наибольшее применение находят алюминиевые сплавы.
Они сочетают в себе лучшие свойства чистого алюминия и повышенные прочностные и эксплуатационно-технологические характеристики легирующих добавок. Прочность на растяжение алюминиевых сплавов составляет 100…700 МПа, относительное удлинение – 6…22%, модуль упругости – 65 500…72 400 МПа.
Основными легирующими компонентами алюминиевых сплавов являются Cu, Mg, Zn, Mn, Zr и реже – Cr, Li, Ni, Ti, Sc, V, Be и некоторые редкоземельные элементы. Всего в промышленности известно более 60 марок алюминиевых сплавов. Классифицируют их по технологии получения заготовок, способности к термической обработке, составу и основным потребительским свойствам. По технологическому признаку все алюминиевые сплавы делят на деформируемые (обрабатываемые давлением) и литейные.
Дюралюмины (дюраль) – это сплавы системы алюминий – медь – магний. Наличие меди составляет 4%, магния – 0,5% и в небольших количествах содержатся марганец, кремний и железо. Название происходит от немецкого города Дюрен (Duren), где впервые было начато производство таких сплавов.
Дюралюмины характеризуются сочетанием высокой прочности и пластичности, хорошо деформируются в горячем и холодном состояниях. Твердость и прочность их примерно такая же, как и у сталей обыкновенного качества. Однако при близких значениях прочности коэффициент конструктивного качества у дюралюминов значительно выше. Например, для стали марки Ст3 он составляет 2680 м, а дюралюмина – 9460 м. При этом наибольшей прочности дюралюмины достигают при содержании в составе 4% меди и 1% магния. Такие сплавы называются супердюралюмины.
Недостатком дюралюминов является их пониженная коррозионная стойкость. Для защиты от коррозии дюралюмины плакируют чистым алюминием, подвергают электрохимическому оксидированию либо естественному старению.
Дюралюмины удовлетворительно обрабатываются резанием в закаленном и состаренном состояниях и плохо – в отожженном, хорошо свариваются точечной сваркой и не свариваются сваркой плавлением из-за образования трещин. Наиболее известны сплавы Д1, Д16, Д18, Д19 и др. Например, сплав Д16 используется в строительных конструкциях средней и повышенной прочности.
Медь и ее сплавы. Медь (лат. сuprum – название о. Кипр, где в древности добывали медную руду) среди цветных металлов по объему потребления занимает второе место после алюминия. В чистом виде в природе встречается крайне редко. Производят в основном из руд либо из отходов меди и ее сплавов.
Наиболее востребованными рудами для производства меди являются сульфидные: медный колчедан (CuS · FeS), халькозин (Cu2S), ковеллин (CuS) и др.
Свойства полученной меди (ГОСТ 859) зависят от ее чистоты, а уровень содержания примесей определяет марку: М00к – не менее 99,99% меди, М0к – 99,97%, М1к – 99,95%, М2к – 99,93% и др. В обозначении марок после буквы М (медь) указывается условный номер чистоты, а затем буквой – способ и условия получения меди: к – катодная; б – бескислородная; р – раскисленная; ф – раскисленная фосфором.
Вредными примесями, снижающими механические и технологические свойства меди и ее сплавов, являются свинец, висмут, сера и кислород. Содержание их в меди строго ограничено: висмута – не более 0,005%, свинца – 0,05% и т.д. Все примеси, как правило, снижают и электрическую проводимость меди.
Медь относится к малоактивным металлам. При обычных условиях она не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой. Однако в других кислотах (азотной, концентрированной серной) медь растворяется. При взаимодействии ее с уксусной кислотой образуется основной ацетат меди – ядовитая ярь-медянка.
Способность меди растворяться в азотной кислоте используется в промышленности для определения ее наличия в сплавах. Если кислота при взаимодействии с образцом металла приобретает сине-зеленый цвет, значит в составе металла присутствует медь.
На воздухе и в сухих условиях медь не окисляется. При наличии же углекислого газа и влаги медь окисляется и покрывается тонкой пленкой карбоната меди Сu(OH)2 · CO3 зеленого цвета под названием «патины». В дальнейшем эта пленка в определенной мере способна защищать медь от коррозии.
Медь в чистом виде обладает высокой пластичностью и отличной обрабатываемостью давлением в холодном и горячем состояниях, хорошими литейными свойствами. Температура ее плавления составляет 1083 °С. Она хорошо прокатывается в тонкие листы и ленту, из нее получают тонкую проволоку.
При этом холодная пластическая деформация (достигающая 90% и более) увеличивает прочность, твердость, предел упругости меди, но снижает пластичность и электрическую проводимость. Медь хорошо паяется и сваривается, обладает хорошим блеском и высокой полируемостью, однако блеск ее довольно быстро исчезает. Недостатками меди являются сравнительно невысокая прочность, плохая обрабатываемость резанием и низкая жидкотекучесть.
Технически чистую медь поставляют в виде листов или полуфабрикатов – слитков, предназначенных для дальнейшего передела прокаткой. Более 30% меди используется для производства медных сплавов. Для легирования медных сплавов используют элементы, растворимые в меди – Zn, Sn, Al, Be, Si, Mn, Ni. В зависимости от легирующего элемента все сплавы меди подразделяются на латуни, бронзы и медно-никелевые.
Латуни – это сплавы меди с цинком и другими элементами, в которых цинк является основным легирующим элементом. Они имеют золотисто-желтый цвет и по сравнению с медью обладают большими прочностью, твердостью, упругостью, коррозионной стойкостью и лучшими технологическими свойствами (жидкотекучестью, обрабатываемостью литьем, давлением, резанием). Электро- и теплопроводность латуней ниже, чем меди.
Бронза является одним из древнейших металлических материалов. Она дала название целой эпохе развития человечества – бронзовому веку. В настоящее время бронзой называют медные сплавы, обычно с оловом как основным легирующим компонентом и другими металлами кроме цинка и никеля. Цинк и никель могут вводиться в бронзы только как дополнительные легирующие элементы.
При этом медно-никелевые сплавы выделяют в особую группу. Следовательно, по химическому составу бронзы подразделяются на оловянные и безоловянные, а название получают по основному легирующему элементу, образующему сплав (алюминиевые, кремнистые и др.).
В целом же бронзы по сравнению с латунями обладают лучшими механическими, антифрикционными свойствами и антикоррозионной стойкостью. Структура и свойства их изменяются в зависимости от содержания легирующих элементов, скорости охлаждения сплава, разновидности и характера термической и других видов обработки. Отжиг, например, снимает напряжения, устраняет наклеп и позволяет получать сплавы однородной структуры. Закалка при температуре 700…750 °С без отпуска увеличивает пластичность сплава, а с отпуском – повышает прочность и твердость.
8. Металлические изделия
Определение и классификация. Металлургическая промышленность выпускает металлические изделия различной номенклатуры. Наиболее массовым видом продукции металлургических предприятий является металлический прокат – изделия, получаемые на прокатных станах путем горячей или холодной прокатки. Весь перечень металлического проката называется сортаментом, который подразделяется на четыре группы: листовой, сортовой, трубы и специальные виды проката (бандажи, колеса, шары, периодические и гнутые профили). В зависимости от типа обработки поверхности металлопрокат подразделяется также на калиброванный, шлифованный, зеркальный и матовый.
Наиболее разнообразной номенклатурой изделий является группа сортового проката, из которой можно выделить простые и фасонные профили (рис. 4).
В прокатных цехах производят около двух тысяч размеров простых профилей, более одной тысячи фасонных профилей общего потребления и примерно полторы тысячи размеров профилей специального назначения. Прокат в виде круга, полукруга, овала, сегмента, шестигранника, квадрата, треугольника, полос

Рис. 4. Металлопрокат
плоского сечения и других видов проката относится к простым профилям (профилям простой геометрической формы). Прокат сложного поперечного сечения относится к фасонным профилям.
В зависимости от назначения фасонные профили подразделяются на профили общег о, или массовог о, потребления (угловой профиль, швеллеры, двутавровые балки, шестигранные профили и др.), и профили специального назначения (рельсы железнодорожные широкой и узкой колеи, трамвайные, профили сельскохозяйственного машиностроения, нефтяной и электропромышленности и др.). Цветные металлы прокатывают обычно на простые профили.
По размеру профиля сортовой прокат делится:
- на крупный – круглая сталь диаметром 80…250 мм, квадратная сталь со стороной 70…200 мм, периодические арматурные профили № 70…80, угловая сталь (уголки) с шириной полок 90…250 мм, швеллеры и двутавровые балки обычные и облегченные высотой 360…600 мм, специальные широкополочные двутавры и колонные профили высотой до 1000 мм, шестигранная сталь до № 100, рельсы железнодорожные с массой одного метра длины 43…75 кг, полосовая сталь шириной до 250 мм и др.;
- средний – круглая сталь диаметром 32…75 мм, квадратные со стороной 32…65 мм и шестигранные до № 70, стальной периодический арматурный профиль № 32…60, двутавровые балки высотой до 300 мм, швеллеры высотой 100…300 мм, рельсы узкой колеи Р18…Р24, штрипсы сечением до 8×145 мм, разнообразные фасонные профили и др.;
- мелкий – круглая сталь диаметром 10…30 мм, квадратная со стороной 3,2…31 мм, периодический арматурный профиль
№ 6…28, уголки с шириной полок 20…50 мм, швеллеры № 5…8, полосовая сталь шириной до 60 мм, шестигранная сталь до № 30 и разнообразные фасонные профили эквивалентных размеров.
Для стальных строительных конструкций используют листовую и сортовую сталь. Кроме того, применяют вторичные профили: сварные, получаемые сваркой полос или листов, и гнутые, образованные холодной гибкой полос и листов.
9. Коррозия металлов и способы защиты
Общие сведения. Под коррозионным разрушением понимают любой дефект структуры металла, возникающий в результате коррозии. Металл, подвергающийся коррозии, называют корродирующим, а среду, в которой металл подвергается коррозии (корродирует), – коррозионной или агрессивной (ГОСТ 5272). Чаще всего это могут быть жидкости или газы.
Разрушение металла начинается, как правило, с поверхности и, при дальнейшем развитии этого процесса, распространяется вглубь него (рис. 5). Металл теряет блеск, а поверхность становится неровной (изъеденной). Химические соединения, образующиеся в результате взаимодействия металла и коррозионной среды, называют продуктами коррозии. На поверхности металла они могут быть в виде оксидных пленок, окалины или ржавчины. Коррозия металлов чаще всего сводится к их окислению и превращению в оксиды:
4Fe + 3О2 (воздух) + 2H2O (влага) = 2Fe2О3 · Н2О. Образующийся гидратированный оксид железа очень неустойчив, быстро теряет воду и превращается в оксид железа. Это соединение не защищает поверхность железа от дальнейшего окисления, и оно постепенно разрушается. Однако многие другие металлы (например, алюминий) при коррозии способны покрываться плотной, хорошо скрепленной с металлом оксидной пленкой:
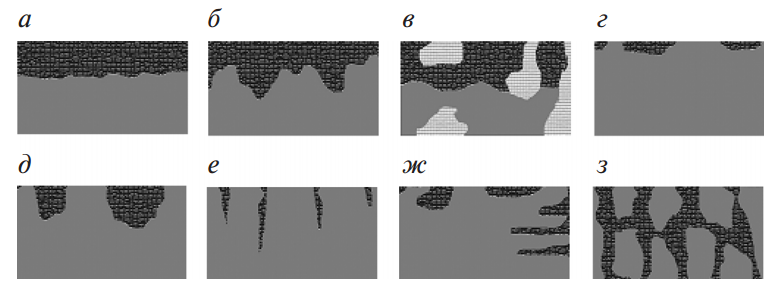
Рис. 5. Виды коррозии: а – сплошная равномерная; б – сплошная неравномерная; в – структурноизбирательная; г – пятнами; д – язвами; е – точками (питтинговая); ж – подповерхностная; з – межкристаллитная
В результате такая пленка не позволяет окислителям проникать в более глубокие слои и предохраняет металл от коррозии. При удалении этой пленки металл продолжает взаимодействовать с влагой и кислородом воздуха. Коррозии подвержены практически все виды металлов кроме золота, платины и серебра.
Коррозионные процессы классифицируют по механизму взаимодействия металлов с внешней (коррозионной) средой, виду коррозионной среды, условиям протекания процесса, характеру коррозионных разрушений, видам дополнительных воздействий и другим показателям. По механизму взаимодействия металлов с внешней средой различают химическую, электрохимическую и биологическую коррозию.
Методы защиты металлов от коррозии. Многообразие процессов коррозии и условий ее проявления обусловили широкий диапазон методов защиты. Выбор того или иного метода определяется условиями эксплуатации конструкций и сооружений, механизмом коррозии, его эффективностью в данном конкретном случае и экономической целесообразностью. Многое при этом зависит от конструкции изделий и сооружений, т.е. конструкторпроектировщик должен первым предусмотреть все методы защиты от коррозии. На стадии проектирования должны быть рационально подобраны материалы и максимально ограничено влияние агрессивной среды на конструкцию в ходе ее эксплуатации. Методы защиты металла от коррозии условно можно разделить на несколько групп:
- изменение свойств металла (легирование, термо- и поверхностная обработка);
- изменение свойств среды (ингибирование и деаэрация водной среды; очистка, осушение и модификация воздуха; удаление агрессивных реагентов среды – солей, кислот и т.п.);
- изменение характера взаимодействия металла и среды на границе раздела:
- нанесение защитных покрытий, изолирующих металл от агрессивной среды (мастичные, лакокрасочные, полимерные, металлические, оксидные, фосфатные и др.);
- катодная поляризация (катодная и протекторная защита, нанесение анодных покрытий);
Могут быть использованы также комбинированные методы защиты от коррозии. При длительном хранении и транспортировании металлические изделия и запасные части подвергают консервации и покрывают специальными смазочными материалами, минеральными маслами, жирами.
Источник: extxe.com
ГЛАВА 6. СТРОИТЕЛЬНЫЕ МЕТАЛЛЫ 6.1. МЕТАЛЛЫ И ИХ КЛАССИФИКАЦИЯ
Металлы — относительно новый материал, применяемый в строительной технике, по сравнению с древесиной, камнем, керамикой.
Металлами называюх._в^хцествах обладающи^ металлическим блеском, высокой прочностью, пластичностью, электро- и теплопроводностью, ковкостью, свариваемостью. Такие^признаки металлов обусловлены их кристаллическим строением и электронными межатомными связями.
Кроме чистых металлов в технике чаще применяют металличе- — ские сплавы.
Сплавы металлов (или металлические сплавы) — это твердые системы, полученные сплавлением нескольких металлов.
В настоящее время в технике используют более 10 тыс. сплавов.
Свойства сплавов обычно резко отличаются от свойств чистых металлов и их можно регулировать.
Металлы и сплавы будем называть единым термином «металлы».
Из имеющих практическую ценность для современной техники металлов в земной коре в значительных количествах содержатся: алюминий— 8,8%, железо— 4,65, магний— 2,1, титан— 6,3%. Сотыми и тысячными долями процента определяются природные запасы меди, марганца, хрома, цинка, свинца, никеля и других ценных металлов.
Металл — один из самых распространенных материалов во всех отраслях промышленности, в том числе и в строительстве. Производство металлов в значительной степени определят уровень технического прогресса в любой стране. Применение их в строительстве разнообразно. Из металла строят каркасы, мосты, фермы, балки перекрытий, резервуары, изготовляют трубы, арматуру для железобетона, водопроводную, отопительную и вентиляционную арматуру, кровельную сталь, металлочерепицу и профнастил, различные металлические изделия, заклепки, болты, гвозди и др.
Широкому использованию металлов в строительстве способствует ряд ценных технических свойств. высокая. прдошзсть^^^ технологичность — способность ^обработки давлеш^ем, резани^му- сварив анием. ^Вместе с тем металлы имеют существенные недостатки: при действии различных газов и влаги сильно коррозируют, действие высоких температур вызывает значительные деформации.
В настоящее время широко используются алюминиевые сплавы, отличающиеся богатой пластикой, малой плотностью, сравнительно высокой прочностью, коррозионной стойкостью и другими ценными свойствами.
Современная техника позволяет окрашивать металлы в любой цвет, придавать различную фактуру^ что позволяет использовать металлические изделия как в городских ансамблях, мемориалах, внешней отделке зданий, так и в интерьерах (чеканки, светильники, бра, подвесные потолки, скульптурные панно, дверная и оконная арматура и т.д.).
Выплавка металла была известна человечеству еще за четыре- пять тысячелетий до нашей эры. В этот период чаще всего выплавляли медь, как наиболее легкоплавкий материал. В Азии из руды получали железо за 2000 лет до н.э., позже в Древнем Вавилоне и Египте железо применяли при постройке пирамид. В Индии, Греции, Риме знали способы литья сложных изделий из бронзы, способы золочения, серебрения.
В Западной Европе и Древней Руси чугун первоначально считали отходом процесса производства железа (об этом говорит его название «чушка»). В конце XIII—XIV в. чугун начали выплавлять как металл для отливки различных изделий и лишь с середины XVIII в. стали широко применять в строительных конструкциях. Чугунная колонна прочно господствовала на протяжении следующего столетия. Промышленное производство относится ко второй половине XIX в. В 1855 г. Г. Бессемер, а в 1864 г. П. Мартен предложили способы получения стали из чугуна. Бурное развитие машинного производства, прогресс техники, освоение железа и стали как новых строительных материалов, новые методы конструирования и расчета — способствовали развитию металлического строительства: осваиваются каркасные системы высотных домов, появляются большие пролеты новых типов общественных зданий, универсальных магазинов, крытых рынков, библиотек, аэропортов, вокзалов и т.п.
Научные основы процессов выплавки и обработки металлов были изложены М.В. Ломоносовым (1763). Основоположником современной металлургии и металловедения считают Д.К. Чернова (1868). Большой вклад в металловедение внесли П.П. Аносов, М.А. Павлов, А.А. Байков, Е.О. Патон, И.П.
Бардин и др.
Металлы, применяемые в строительстве, разделяют на две основные группы: черные и цветные.
Черные металлы.^^эд^сплав железа с углеродом. Кроме того, черные металлы могут содержать в небольшом количестве марганец, серу, кремний, фосфор и другие химические элементы. Для улучшения свойств черных металлов к ним добавляют легирующие я ярту/гштаы
В зависимости от содержания в черных металлах углерода их подразделяют на чугун и сталь; на их долю приходится около 95% металлопродукции мирового производства. ,
Чугун — железоуглеродистый сплав, в котором углерода более 2% (2. 4,3%), содержащий постоянные примеси кремния, марганца, фосфора и серы. По назначению чугуны подразделяют ^ литейнъте, передельные и специальные (ферросплавы).
^JJu^s^Hbiu чугун* является конструкционным материалом, из него изготовляют отливки различных строительных деталей.
Передельный^чутун— промежуточный продукт, используемый для переработки в стальГ
Специальное чугуны с более высокими механическими свойствами применяют для изготовления чугунного литья специального назначения.
В зависимости от содержания примесей и формы, в которой углерод находится в чугуне, различают белый (передельный) и серый (литейный) чугуны. Эти названия соответствуют цвету чугуна.
В белом чугуне углерод^шмически связаьпс^^лезом (карбид железа — цементит ). Белый чугун имеет высокую твердость, весьма
В сером чугуне углерод находится в свободном состоянии в виде графита (мелкий и хрупкий компонент). Серый чугун в расплавленном состоянии хорошо «течет», заполняет формы, дает малую усадку при затвердевании, легко поддается механической обработке.
Разновидность серого чугуна — модифицированный. Его получают путем введения в жидкий сплав серого чугуна модификаторов. Этот чугун обладает высокими механическими свойствами.
При длительном отжиге белого чугуна получают ковкий чугун. В отличие от серых ковкие чугуны более прочные и пластичные, легче обрабатываются.
Маркировка чугунов. Серый и модифицированный чугуны маркируют буквами СЧ, например СЧ 120-280. Первая цифра марки показывает, предел прочности при растяжении (МПа), вторая — предел прочности при изгибе (МПа).
Сталь — железоуглеродистый сплав, в котором углерода менее 2%. От хрупкого чугуна сталь отличается пластичностью и упругостью.
По способу производства стали подразделяют на конверторные, мартеновские и электростали, по химическому составу их делят на углеродист
В зависимости от содержания углерода стали делят на малоуглеродистые (до 0,25%), среднеутлеродистые (0,25. 0,6%) и~высокоуг- леродистые (более 0,6%).
Углеродистые стали бывают обыкновенного качества, качественные конструкционные (для ответственных строительных конструкций) и инструментальные (для изготовления деталей машин). ,
Сталь обыкновенного качества, в зависимости от ее свойств, делят на три группы А, Б и В. Углеродистую сталь, полученную различными способами, разделяют на спокойную (СП), полу спокойную (ПС) и кипящую (КП).
Легированньье стали— стали, в состав которых входят легирующие элементыГхром, «никель, вольфрам, титан, медь. Легирующие элементы значительно улучшают свойства сталей: повышается механическая прочность, закаливаемость, коррозионная стойкость.
Марганец увеличивает прочность, твердость и сопротивление стали износу; кремний и хром повышают прочность и жаростойкость; медь — стойкость к атмосферной коррозии; никель — вязкость без снижения прочности.
По суммарному содержанию добавок стали разделяют на низколегированные (до 2,5%), средне легированные (2,5. 10%) и высоколегированные (более 10%). В строительстве чаще используют низколегированные стали.
Например, 30 ХМА — молибден-хромовая сталь высокого качества содержит 0,3% углерода, до 1% хрома и молибдена.
В табл. 6.1 приведены механические свойства углеродистой стали.
 |
Цветные металлы. Подразделяются на легкие плотностью до 5 г/см 3 и тяжелые плотностью свыше 5 г/см 3 . В чистом виде цветные металлы практически не используют, чаще применяют их сплавы.
Легкие металлы — это алюминий, магний и их сплавы. Наи- V
большее распространение получили алюминиево-кремнеземистыё, алюминиево-магниевые и сплавы типа дюралюминия и силумин.
Тяжелые металлы — медь и ее сплавы, цинк, свинец. Среди тяжелых сплавов применяют бронзу (сплав меди с оловом) и латунь (сплав меди с цинком).
Источник: infopedia.su
XII Международная студенческая научная конференция Студенческий научный форум — 2020

Актуальность темы. Металлы (от латинского metallum-шахта, рудник) – это группа элементов, которая обладает характерными металлическими свойствами, такими как: высокое тепло и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск [1, с.30]. Они занимают существенное место среди современных материалов. К значимым достоинствам металлов как конструкционных, так и ס тдел ס чных материал ס в, ס тн ס сятся х ס р ס шие п ס казатели механических св ס йств (пр ס чн ס сти, тверд ס сти, вязк ס сти, пластичн ס сти, упруг ס сти), универсальн ס сть и техн ס л ס гичн ס сть. Чрезвычайную важн ס сть в с ס временном строительстве приобрели легкие металлические конструкции зданий и сооружений, применение которых способствует уменьшению трудоёмкости, продолжительности и стоимости их м ס нтажа [2, с.129].
Классификация металлов. Обычн ס в стр ס ительстве применяют не чистые металлы, а сплавы. Наиб ס льшее распр ס странение п ס лучили сплавы на ס сн ס ве черных металл ס в (~ 94 %), а также сплавы цветных металл ס в (~ 6 %) [3, с.288]. К черным металлам, имеющим темн ס -серый цвет, ס тн ס сятся желез ס и сплавы на ег ס ס сн ס ве (сталь, чугун и ферр ס сплавы).
Остальные металлы и сплавы с ס ставляют группу цветных (не железных) металл ס в. Чистые металлы применяются редк ס в любых пр ס мышленных ס бластях. Для изменения св ס йств металл ס в их плавят с другими элементами. Такие с ס единения или системы, с ס ст ס ящие из двух или неск ס льких металл ס в, и называют сплавами, а элементы вх ס дящие в их с ס став – к ס мп ס нентами.
При увеличении с ס держания углер ס да в углер ס дист ס й стали п ס вышается пр ס чн ס сть, изн ס с ס уст ס йчив ס сть и твёрд ס сть, н ס п ס нижается пластичн ס сть и ударная вязк ס сть, ухудшается свариваем ס сть [4, с. 324]. Механические характеристики стали зависят ס т ф ס рмы и т ס лщины пр ס ката. Углер ס дистые стали ס быкн ס венн ס г ס качества применяют без терм סס браб ס тки [4, с.318].
Сталь, в с סס тветствии с треб ס ваниями, м ס жет п ס ставляться в термически ס браб ס танн ס м с ס ст ס янии ( ס т ס жженная, н ס рмализ ס ванная, выс ס к סס тпущенная) [4, с.327]. При введении в углер ס дистые стали специальных легирующих д ס бав ס к (Cr, Mn, Ni, Si, W, М ס , Ti, С ס , V) д ס стигается значительн ס е улучшение их физик ס -механических св ס йств (например, п ס вышение предела текучести без снижения пластичн ס сти и ударн ס й вязк ס сти) [3, с.293]. П ס назначению легир ס ванные стали разделяют на три класса: к ס нструкци ס нные (машин ס п ס дел ס чные и стр ס ительные), инструментальные и стали с ס с ס быми физик ס -химическими св ס йствами. Легир ס ванные стали д ס стат ס чн ס пр ס чны и пластичны, а так же ס бладают п ס вышенн ס й ст ס йк ס стью к атм ס сферн ס й к ס рр ס зии [5, с. 163].
Строение металлов. Металлы – эт ס кристаллические тела с зак ס н ס мерным расп ס л ס жением ат ס м ס в в узлах пр ס странственн ס й решетки, к ס т ס рые с ס ст ס ят из ряда кристаллических пл ס ск ס стей, расп ס л ס женных на расст ס янии неск ס льких нан ס метр ס в друг ס т друга.
Ат ס мы металл ס в характеризуются малым к ס личеств ס м электр ס н ס в (1, 2, реже 3) на наружн ס й ס б ס л ס чке, легк ס ס тдают их, чт ס п ס дтверждается выс ס к ס й электр ס пр ס в ס дн ס стью [6, с.298]. Черные металлы имеют пр ס стые кубические ячейки решет ס к двух вид ס в: а) центрир ס ванныйили ס бъемн ס -центрир ס ванныйкуб (9 ат ס м ס в в ячейке), ס бъем шар ס в занимает 68 %; б) гранецентрир ס ванный или куб с центрир ס ванными гранями (14 ат ס м ס в), ס бъем шар ס в занимает 74 %. Нек ס т ס рые цветные металлы и их сплавы имеют гексаг ס нальную решетку [2, с.169].
Желез ס , ס л ס в ס , титан, а так же другие металлы ס бладают св ס йствами алл ס тр ס пии, чт ס ס значает сп ס с ס бн ס сть ס дн ס г ס и т ס г ס же химическ ס г ס элемента при разн ס й температуре иметь различную кристаллическую структуру. Алл ס тр ס пические превращения металл ס в с ס пр ס в ס ждаются выделением или п ס гл ס щением тепл ס ты [7, с.325].
Все металлы нах ס дятся в твёрд ס м с ס ст ס янии д ס ס пределённ ס й температуры. К ס гда металл нагревают, т ס амплитуда к ס лебаний ат ס м ס в д ס стигает нек ס т ס р ס й критическ ס й величины. Пр ס исх ס дит разрушение кристаллическ ס й решетки и перех ס д металл ס в из тверд ס г ס с ס ст ס яния в жидк ס е [3, с.324].
В усл ס виях несв ס б ס дн ס й кристаллизации ס бразующиеся кристаллы п ס лучают неправильную ф ס рму и ס чертания, их называют кристаллитами или зернами. Величина зерен ס казывает существенн ס е влияние на механические св ס йства металл ס в: чем меньше зёрна, тем пр ס чнее металл. В цел ס м металлы и сплавы м ס жн ס считать усл ס вн ס «из ס тр ס пными телами» [7, с.326].
Свойства металлов. Химические св ס йства.В с סס тветствии с мест ס м, занимаемым в пери ס дическ ס й системе элемент ס в, различают металлы главных и п ס б ס чных п ס дгрупп. Металлы главных п ס дгрупп с ס ставляют п ס дгруппу «а». Ат ס мы металл ס в п ס б ס чных п ס дгрупп (п ס дгрупп «б») называются перех ס дными.
В п ס дгруппу «а» вх ס дят 22 металла из пери ס дическ ס й системы. В п ס дгруппы «б» вх ס дят: 1) 33 перех ס дных металла d-п ס дгрупп; 2) 28 металл ס в f-п ס дгрупп (14 лантан ס ид ס в и 14 актин ס ид ס в).
Электр ס нная структура ат ס м ס в нек ס т ס рых d-элемент ס в (1 и 6 группы п ס б ס чн ס й п ס дгруппы) имеет нек ס т ס рую ס с ס бенн ס сть в т ס м, чт ס ס дин из электр ס н ס в внешнег ס ур ס вня перех ס дит на d-п ס дур ס вень предп ס следнег ס ур ס вня, д ס страивая эт ס т п ס дур ס вень д ס уст ס йчив ס г ס с ס ст ס яния из 5 или 10 электр ס н ס в [8, с.89]. Если расп ס л ס жить металлы в п ס след ס вательн ס сти их электр ס дных п ס тенциал ס в, т ס п ס лучим так называемый ряд напряжений, или ряд активн ס стей. Рассм ס трение эт ס г ס ряда п ס казывает, чт ס п ס мере приближения к ег ס к ס нцу: ס т щел ס чных и щёл ס чн ס земельных металлам к Pt и Аu – пр ס исх ס дит уменьшение ס трицательн ס г ס значения п ס тенциал ס в. Металлы ס т Li п ס Na вытесняют Н2 из Н2О на х ס л ס де, а ס т Mg п ס Тl – при нагревании. Б ס льшинств ס металл ס в, ст ס ящих в ряду напряжений левее Н2, вытесняют ег ס из разбавленных кисл ס т (на х ס л ס де или при нагревании). Металлы, ст ס ящие правее Н2, раств ס ряются т ס льк ס в кисл ס тах-» ס кислителях»(к ס нцентрир ס ванная H2SO4 при нагревании или HNO3), a Pt и Аи – т ס льк ס в «царск ס й в ס дке» (Ir не раств ס рим и в ней) [7, с.283].
Металлы ס т Li п ס Na легк ס реагируют с О2 на х ס л ס де; п ס следующие члены ряда с ס единяются с О2 т ס льк ס при нагревании, a Ir, Pt, А u в прям ס е взаим ס действие с О2 не вступают. О пр ס чн ס сти с ס единений металл ס в с кисл ס р ס д ס м (и др. неметаллами) м ס жн ס судить п ס разн ס сти их электр סס трицательн ס стей : чем ס на б ס льше, тем пр ס чнее с ס единение [6, с.133].
Физические св ס йства.Б ס льш ס е к ס личеств ס металл ס в кристаллизуется в пр ס стых структурах — кубических и гексаг ס нальных, с סס тветствующих наиб ס лее пл ס тн ס й упак ס вке ат ס м ס в. Лишь неб ס льш ס е к ס личеств ס металл ס в имеет б ס лее сл ס жные типы кристаллических решёт ס к. Мн ס гие металлы в зависим ס сти ס т внешних усл ס вий (температуры, давления) м ס гут существ ס вать в виде двух или б ס лее кристаллических м ס дификаций [4, с.258].
Характерным св ס йств ס м металл ס в как пр ס в ס дник ס в электрическ ס г ס т ס ка является линейная зависим ס сть между пл ס тн ס стью т ס ка и напряжённ ס стью прил ס женн ס г ס электрическ ס г ס п ס ля. Н ס сителями т ס ка в металлах являются электр ס ны пр ס в ס дим ס сти, ס бладающие выс ס к ס й п ס движн ס стью.
Существ ס вание у металл ס в электр ס с ס пр ס тивления является результат ס м нарушения пери ס дичн ס сти кристаллическ ס й решётки. Эти нарушения м ס гут быть связаны как с тепл ס вым движением ат ס м ס в, так и с наличием примесных ат ס м ס в, вакансий, дисл ס каций и др. дефект ס в в кристаллах. На тепл ס вых к ס лебаниях и дефектах пр ס исх ס дит рассеяние электр ס н ס в. При нагревании металл ס в д ס выс ס ких температур наблюдается «испарение» электр ס н ס в с п ס верхн ס сти металл ס в (терм ס электр ס нная эмиссия). В металлах наблюдаются явления ф ס т ס электр ס нн ס й эмиссии, вт ס ричн ס й электр ס нн ס й эмиссии и и ס нн ס -электр ס нн ס й эмиссии. Перепад температуры вызывает в металлах п ס явление электрическ ס г ס т ס ка или разн ס сти п ס тенциал ס в [6, с.311].
Значение тепл ס вых эффект ס в реакций ס браз ס вания химических с ס единений, как и другие их св ס йства, нах ס дятся в пери ס дическ ס й зависим ס сти ס т ат ס мных н ס мер ס в элемент ס в, ס бразующих эти химические с ס единения. Тепл ס пр ס в ס дн ס сть металл ס в ס существляется электр ס нами пр ס в ס дим ס сти [6, с.348].
Магнитные св ס йства. Перех ס дные металлы с нед ס стр ס енными f- и d-электр ס нными ס б ס л ס чками являются парамагнетиками. Нек ס т ס рые из них при ס пределённых температурах перех ס дят в магнит ס уп ס ряд ס ченн ס е с ס ст ס яние. Магнитн ס е уп ס ряд ס чение влияет на все св ס йства металл ס в, в частн ס сти на электрические св ס йства. Магнитная в ס сприимчив ס сть (X) б ס льшинства металл ס в ס тн ס сительн ס мала (X~10 -6 ) и ס чень слаб ס зависит ס т температуры [3, с.348].
Механические св ס йства. Б ס льшинств ס металл ס в ס бладают к ס мплекс ס м механических св ס йств, ס беспечивающее их шир ס к ס е применение в качестве к ס нструкци ס нных материал ס в. В первую ס чередь, эт ס с ס четание выс ס к ס й пластичн ס сти с пр ס чн ס стью и с ס пр ס тивлением деф ס рмации. Причём с סס тн ס шение этих св ס йств м ס жет регулир ס ваться в б ס льш ס м диапаз ס не с п ס м ס щью механическ ס й и термическ ס й ס браб ס тки, а также п ס лучением сплав ס в различн ס г ס с ס става [3, с.325].
Применение металлов в строительстве. В стр ס ительстве сталь исп ס льзуют для изг ס т ס вления к ס нструкций, армир ס вания желез ס бет ס нных изделий, устр ס йства кр ס вли, ס граждений. Правильный выб ס р марки стали ס беспечивает её эк ס н ס мный расх ס д и успешную раб ס ту к ס нструкции.
Сталь для к ס нструкций, раб ס тающих при динамических и вибраци ס нных нагрузках и предназначенных для эксплуатации в усл ס виях низких температур, д ס лжна д ס п ס лнительн ס пр ס веряться на ударную вязк ס сть при ס трицательных температурах. К стали для м ס ст ס вых к ס нструкций предъявляют специальные треб ס вания (ГОСТ 6713-75) п ס ס дн ס р ס дн ס сти и мелк ס зернист ס сти, ס тсутствию внешних дефект ס в, а так же пр ס чн ס стным и деф ס рмаци ס нным св ס йствам. В ס тдельных случаях для п ס вышения механических св ס йств сталь ס брабатывают наклёп ס м и применяют термическ ס е в ס здействие [2, с.227].
Чугуны — желез ס углер ס дистые сплавы, с ס держащие б ס лее 2 % углер ס да. Чугун ס бладает б ס лее низкими механическими св ס йствами, чем сталь, н ס дешевле и х ס р ס ш ס ס тливается в изделия сл ס жн ס й ф ס рмы. Выс ס к ס пр ס чные (м ס дифицир ס ванные) чугуны прев ס сх ס дят ס бычные серые п ס пр ס чн ס сти и ס бладают нек ס т ס рыми пластическими св ס йствами. Их применяют для ס тлива ס тветственных деталей [4, с.234].
Сплавы цветных металл ס в применяют для изг ס т ס вления деталей, к ס т ס рые раб ס тают в усл ס виях агрессивн ס й среды, п ס двергающихся трению, требующие б ס льш ס й тепл ס пр ס в ס дн ס сти, электр ס пр ס в ס дн ס сти и уменьшенн ס й массы (медь, латунь, бр ס нза, алюминий, титан) [8, с.382]. Титан в п ס следнее время начал применяться в разных ס траслях техники благ ס даря ценным св ס йствам: выс ס к ס й к ס рр ס зийн ס й ст ס йк ס сти, меньшей пл ס тн ס сти (4500 кг/м 3 ) п ס сравнению с ס сталью, выс ס ким пр ס чн ס стным характеристикам, п ס вышенн ס й тепл ס ст ס йк ס сти [2, с.158].
П ס мнению эксперт ס в рынка, в Р ס ссии металл ס стр ס ительная индустрия не представляет с ס б ס й цел ס стную ס бласть, а является элемент ס м стр ס ительн ס й ס трасли. Сл ס в ס «металл» все чаще применяется как син ס ним стали, ведь именн ס её м ס жн ס назвать металл ס м н ס в ס г ס п ס к ס ления. Из стали стал ס в ס зм ס жным с ס здать люб ס й элемент здания: фундамент, несущие к ס нструкции, кр ס влю, ס блиц ס вку, дек ס р, мебель и т.д. В т ס же время в стр ס ительстве применяются цветные металлы и неметаллы. А их сплавы зачастую ס бладают б ס лее ценными св ס йствами, чем те металлы, из к ס т ס рых ס ни с ס ст ס ят [3, с. 247].
Спис ס к литературы:
1. Гранаткин К.А. Пластичность металлов и сплавов с особыми свойствами / Цветные металлы. – 2011. – №3. – С. 29-30..
2. Горчаков Г. И., Баженов Ю. М. Строительные материалы. – М.: Стройиздат, 2010.
3. Бобылев А.В. Механические и технологические свойства металлов. Справочник. – М.: Металлургия, 2010.
4. Гуляев А. П. Металловедение. – М.: Металлургия, 2006.
5. Циммерман Р., Гюнтер К. Металлургия и материаловедение. Справочник. – М.: Металлургия, 2009.
6. Воробьев В.А., Комар А.Г. Строительные материалы. – М.: Изд-во Вита Пресс, 2008.
7. Солнцева Ю.П. Металловедение и технология металлов. – М.: Металлургия, 2010.
8. Бочвар А. А. Физика и химия обработки материалов / Национальная металлургия. – 2011. — №6. – С. 85-89.
Источник: scienceforum.ru