Приемка в аптеке — важный этап на пути лекарственного препарата от поставщика к потребителю. Приемочный контроль — законодательная обязанность аптечной организации и одна из трудовых функций фармацевтических работников. В понятие приемочного контроля входит больше, чем сверка по количеству и наименованию, чтобы избежать недостачи или пересорта. Цель приемочного контроля — не допустить попадание недоброкачественного товара в аптеку, а в дальнейшем — к покупателям.
Что включает в себя приемочный контроль?
- Согласно Приказам 646н и 647н при приемке работники аптеки проверяют 1. Соответствие поступившего товара товаросопроводительным документам по:
- ассортименту
- количеству
- качеству.
- Соблюдение специальных условий хранения и перевозки (при наличии таких требований).
- Транспортную тару на наличие повреждений.
СОП — стандартная операционная процедура
На основании Приказа 647н каждая аптека разрабатывает для сотрудников пошаговый алгоритм — стандартную операционную процедуру (СОП) приемки. Условия приема (отказа в приеме), возврата товара, сроки регламентируются договором поставки между аптечной организацией и поставщиком. СОП — это практическое руководство для аптечного работника, в котором учитываются все детали и четко прописываются действия в том или ином случае.
Программа курса Эксперт для Менеджеров контроля качества #обучение #курсы #ОКК #МКК #бизнес #okkcrm
Кем и где проводится приемка аптечного товара?
Руководитель аптеки назначает приказом работников, ответственных за приемку, а также состав приемочной комиссии (обычно из трёх человек) на случай выявления ненадлежащего товара и расхождений во время приемочного контроля. Приемку материально-ответственное лицо проводит в специально выделенной и оборудованной для размещения принимаемого товара зоне приемки.
Должны быть стол, поддоны, стеллажи. Также в аптеке должна быть выделена карантинная зона для размещения несоответствующего товара. Это может быть отдельный шкаф, полка, ящик, где хранится несоответствующий товар, и где он никак не пересечется с обычным товаром. В холодильнике это тоже может быть отдельный ящик. Обязательно подписывается «карантинная зона».
Основные этапы приемки
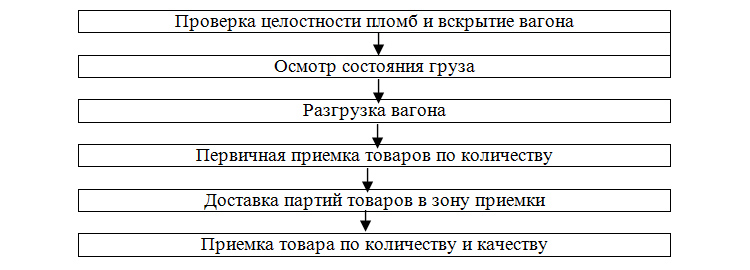
- Экспертиза товаросопроводительных документов и прием по количеству мест
Аптечный работник проводит внешний осмотр транспортной тары на наличие загрязнений, подтеков, повреждений. Проводит контроль вскрытия: на коробках не должно быть следов вскрытия (например, если разрезали и заново заклеили скотчем). Этому служат специальные этикетки, наклейки-пломбы на коробках и пломбы на пластиковых контейнерах. Пересчитывает количество мест. Проверяет комплектацию документов — в него должны входить:
- накладная
- протокол согласования цен (на ЖНВЛП)
- реестр документов, подтверждающих качество
- счет-фактура.
В документах сотрудник проверяет реквизиты: отправитель, получатель (аптека), наличие необходимых печатей и подписей. Если претензий нет, принимающий проставляет в экземпляре поставщика (транспортная накладная, путевой лист) штамп, подпись, количество принятых мест и дату.
Приемочный контроль/ Арматурные работы плиты перекрытия
В случае нарушения целостности, подозрении в том, что товар может быть поврежден, ответственный работник вскрывает тару в присутствии представителя поставщика (водителя-экспедитора) и оценивает визуально качество товара, соответствие документам по наименованию и количеству. Удостоверившись в полном соответствии фармработник принимает товар.
NB! Для термолабильных препаратов дополнительно оценивается соблюдение температурного режима перевозки (распечатка терморегистраторов, показания термоиндикаторов).
На первом этапе могут быть выявлены несоответствие количества мест, нарушения температурного режима, брак, порча, недостача (при вскрытии), неполнота комплекта, неправильное оформление документов. Чаще всего случается недовоз мест (не догрузились на складе, перепутали аптеки, выгрузили не там) и мятые коробки.
Общая схема действий в этих случаях выглядит следующим образом:
- Комиссия по приемке товара составляет соответствующий акт («Акт расхождения по количеству/качеству«, «Акт боя/брака/порчи») в 2-х экземплярах.
- Ответственное лицо уведомляет поставщика о выявленных несоответствиях (нарушениях) и передает один экземпляр «Акта. » поставщику.
- Товар маркируют «забракован при приемке«, размещают в карантинных зонах (для термолабильных отдельная зона в холодильнике) и не принимают до устранения нарушения (несоответствия) поставщиком в случаях, когда это возможно, либо возвращают товар.
- Для возврата товара комиссия составляет «Акт возврата поставщику». Возврат осуществляют согласно условиям договора.
2. Собственно приемочный контроль
На этом этапе фармработник:
- Сличает наименование, количество, производителя, серии, сроки годности фактически поступивших лекарственных препаратов с указанными в товаросопроводительных документах.
- Проверяет наличие сведений о документах, подтверждающих качество, (декларация или сертификат соответствия) в реестре (или ином документе) поставщика. Идентифицировать документы качества при необходимости можно на сайтах Федеральной службы по аккредитации и органов сертификации.
- Проводит контроль поступивших препаратов по базе Росздравнадзора о приостановленных или изъятых из обращения лекарств.
- Оценивает внешний вид товара по показателям «описание», «упаковка», «маркировка». Товар не должен иметь изменений органолептических характеристик, упаковка должна быть целой, соответствующей свойствам товара, с нанесением необходимой информации (наименование, серия, срок годности, производитель, способ применения, режим хранения и др.). Полные требования к маркировке лекарственных препаратов содержатся в ст. 46 Федерального закона №61-ФЗ «Об обращении лекарственных средств».
4) С появлением цифровой маркировки — считывает QR-код с каждого маркированного препарата.
NB! В первую очередь проводится приемочный контроль термолабильных препаратов.
При выявлении несоответствий по количеству/качеству товара:
- Комиссия составляет «Акт о расхождении по количеству/качеству товара» или «Акт боя/брака/порчи».
- Ответственный работник информирует Поставщика (по телефону, электронным письмом) и оформляет Претензию в программе. В журнале «Учета претензий» работник делает запись.
- В случае выявления недоброкачественного товара, товара, изъятого из обращения или обращение которого приостановлено, ответственное лицо уведомляет территориальный орган Росздравнадзора, например по электронной почте.
- Несоответствующий товар с маркировкой «забраковано при приемке» сотрудник помещает в карантинную зону для последующего возврата поставщику или устранения несоответствия. Для препаратов, обращение которых временно приостановлено предусмотрена отдельная карантинная зона от фальсифицированных, недоброкачественных, контрафактных товаров и товаров с истекшим сроком годности.
- Для возврата товара уполномоченный сотрудник оформляет документы: «Акт списания» и накладную на возврат. Товар вместе с накладной передает представителю поставщика.
3.Документальное оформление принятых товаров, оприходование и размещение по местам хранения.
Если предыдущие этапы прошли гладко, ответственный за приемку проставляет в товаросопроводительных документах печать аптеки, дату, свою должность, ФИО, роспись. После этого приходует электронные накладные в аптечной программе, распечатывает стеллажные карты (для лекарственных препаратов и БАД), ценники и передает для размещения по местам хранения. Товаросопроводительные документы подшивает в специально предназначенную папку.
Нелекарственные товары аптечного ассортимента
В аптеку поступают не только ЛС, но и медицинские изделия, пищевая продукция аптечного ассортимента (детское питание, минеральные воды, БАД и др.), парфюмерно-косметическая продукция, детские товары, дезсредства, предметы гигиены и ухода за больными. При приемочном контроле этих групп товаров схема проверки и действий будет аналогичная. Приемщик проверяет внешний вид, количество, наименование, серию, производителя, срок годности, номер партии при наличии, правильность оформления документов, информацию о документах качества, сведения о забраковке товара. Товар, несоответствующий документам, ненадлежащего качества, некомплектный, поступивший без тары или упаковки подлежит возврату поставщику.
- Если несоответствие обнаружено в присутствии представителя поставщика, комиссия составляет «Акт возврата« (при нарушении температурного режима) или «Акт расхождения по количеству/качеству» или «Акт боя/брака/порчи» в 2-х экземплярах. Уведомляет поставщика о возврате и вместе с экземпляром «Акта. » возвращает товар.
- Если несоответствие обнаружено позднее, комиссия составляет «Акт расхождения по количеству/качеству» или «Акт боя/брака/порчи», уведомляет поставщика о выявлении несоответствия и необходимости возврата. Возврат производится согласно условиям договора. Копия акта направляется поставщику в электронном виде. Товар и экземпляр акта передаются представителю поставщика при следующей поставке.
- При отказе поставщика принять несоответствующий товар, что случается редко, разногласие рассматривается в судебном порядке.
Нелекарственные товары ненадлежащего качества размещаются в карантинной зоне отдельно от ЛС.
Таблица. Электронные ресурсы для контроля качества товаров аптечного ассортимента.
Источник: pharmznanie.ru
Приемка – это проверка соответствия нормативным требованиям
При проведении каких-либо работ или приобретении товара необходимо подтверждение того, что полученные услуги или материальные ценности соответствуют требованиям, предусмотренным проектной документацией или договором купли-продажи. Это проверяется уполномоченными представителями заказчика или покупателя, а сам процесс проверки называется приемкой.
Понятие приемки и ее виды

Существует большое количество толкований самого термина в различных словарях и нормативных актах, это зависит от предмета, о котором идет речь в каждом конкретном случае. Одно дело, когда идет выпуск новой единицы продукции, и совсем другое, когда она поставляется покупателю. В обоих случаях процедуры проверки товара носят название «приемка», однако в это слово вкладывается различный смысл.
- Когда происходят закупки, то относительно поставленной продукции приемка – это определенный процесс проверки изделия или материала касательно соответствия его количества, качества и комплектности техническим условиям или характеристикам, указанным в тексте договора о купле-продаже. Например, если компания заказала партию подшипников, то при получении проверяется количество отгруженного товара и его основные характеристики. Испытания не осуществляются, если в ходе использования возникнут проблемы с качеством, то производителю будут предъявлены претензии.
- К приемке также относятся мероприятия, проводимые непосредственно на предприятии с целью проверки качества выпускаемой продукции и ее соответствия спецификациям и стандартам качества. Для этого на многих заводах и фабриках создаются специальные отделы технического контроля (ОТК). В данном случае проводятся испытания отобранных образцов продукции, в случае выявления брака или несоответствия спецификациям вносятся необходимые изменения в производственный процесс.
Существуют различные виды контроля соответствия в зависимости от особенностей выпускаемых изделий: швейных, инструментальных, электротехнических, литейных и т.д. Свои особенности имеют, в частности, приемка военная и в атомной энергетике, в которых очень строгие правила относительно используемых материалов, производителей и примененных технологий производства, требуется высокий запас прочности от предложенного изделия, отклонения от установленных стандартов не допускаются.
Если же речь идет о капитальном строительстве, ремонте, реновации или реконструкции, то под приемкой понимается установление соответствия выполненных работ требованиям проектной и технической документации, строительным нормам и правилам. Приемка построенного объекта в эксплуатацию представляет собой юридическое действие, совершаемое специально созданным органом (приемочной комиссией) и направленное на официальное признание факта возведения объекта и соответствия его ранее утвержденному проекту.
Общий порядок проведения испытаний и приемки изготовленной продукции
В странах СНГ действует Межгосударственный стандарт от 1998 года, регулирующий правила проведения испытаний и приемки продукции. Он используется для всех видов выпускаемых товаров, кроме тех, для которых утверждены специальные правила. Его действие распространяется на всю продукцию, предназначенную к поставке заказчику (покупателю), и на производителей всех видов собственности.
Существует две категории испытаний, которые используются:

- Приемосдаточные. Организовываются для подтверждения соответствия товара стандартам, образцу-эталону или контрольному образцу. Может применяться выборочный или сплошной контроль, также в зависимости от текущих результатов он может усиливаться или ослабляться. После положительного вывода на товар и в документы ставится клеймо ОТК. При выявлении дефектов изделие возвращается на повторную проверку. Если продукт бракуется, то принимается решение о его списании, утилизации, использовании или снижении сорта.
- Периодические. Проводятся регулярно по одному из заданных критериев: количество изготовленной продукции или время. Иногда по договоренности проверяется контролируемая партия товара. Если выявлено серьезное несоответствие, то вся партия заменяется другой, а результаты анализируются для устранения обнаруженных дефектов. Повторное непрохождение периодических испытаний может стать причиной изменения технической документации или полного снятия изделия с производства.
В совокупности оба вида испытаний обязаны обеспечивать достоверное подтверждение всех предусмотренных техническими условиями свойств продукции. В некоторых случаях ограничиваются лишь приемосдаточными испытаниями, если их достаточно для проверки качества изделий.
Проверка на соответствие продукции производится отделом технического контроля до ее отправки заказчику или покупателю. Если в контракте предусмотрен механизм независимого контроля качества, то представители заказчика или избранная им независимая организация проводят проверку с использованием собственного оборудования в присутствии представителей ОТК изготовителя. Иногда процесс приемки объединяется с приемосдаточными испытаниями, иногда подразделяется на два независимых этапа: испытания и окончательная приемка. Соответственно, оформляется один общий документ или два отдельных.
Продукция предоставляется для изучения одной или несколькими партиями, либо поштучно. В случае успешного прохождения ранее проведенных периодических, а также приемосдаточных испытаний делается вывод о пригодности продукции. Если речь идет об изделии, выпуск которого только налажен и производится впервые, то следует провести квалификационные испытания, которые временно заменят собой периодические до наступления времени их проведения.
Приостановка приемки происходит при таких условиях:
- изделие не выдержало периодических испытаний;
- партии или единицы продукции, дважды предъявленные для испытаний, оба раза не подтвердили своего соответствия;
- выявлено нарушение в проведении технологического процесса или установлены такие несоответствия, которые могут стать причиной неисправимых дефектов изделия;
- другие случаи, предусмотренные действующей документацией изготовителя.
Процесс возобновляется по решению уполномоченных представителей поставщика и органа приемки после того, как причина возникновения дефекта будет устранена и составлен соответствующий акт. Если причиной приостановки стали отрицательные результаты периодических испытаний, то возобновление процесса возможно после выявления причины неполадки, ее ликвидации и проведения повторных периодических испытаний.
Партия товара, который соответствует требованиям и принят, комплектуется, маркируется и упаковывается в соответствии с условиями контракта, пломбируется представителем ОТК и другого органа контроля (при его наличии). На эту партию готовится пакет документов, которые дают возможность покупателю компетентно выбрать товар. После комплектации партия отгружается получателю или передается на ответственное хранение.
Поставщик обязан обеспечить необходимое качество продукции с момента признания его соответствующим условиям договора до момента доставки покупателю, если это прописано в контракте.
Все процессы, относящиеся к приемке, предусматривают обязательное документальное оформление. В частности, составляются такие официальные бумаги:
- протокол приемосдаточных испытаний;
- акт о результатах испытаний периодических;
- акт о результатах испытаний типовых.
Утверждаются они в шапке представителями изготовителя продукции и органа приемки, а подписываются представителем ОТК или членами комиссии.
Промежуточная и окончательная приемка, их особенности
В случаях, когда речь идет о продукции или объектах, изготовление которых состоит из нескольких или многих взаимосвязанных и взаимозависимых процессов, появляется необходимость контроля качества по завершении каждого из этапов. Это дает возможность оценить возможность перехода к следующей фазе работ. Такая практика часто применяется при выполнении работ, связанных с капитальным строительством.
В частности, к промежуточной контрольной приемке в рамках технического надзора застройщика или заказчика могут относиться такие процессы:
- скрытые (которые в дальнейшем невозможно проверить) и разбивочные (разбивка основных осей и красных линий) работы;
- окончание конструктивных элементов (нулевой цикл, фундамент, несущие конструкции) или отдельных видов работ;
- зданий или их составных частей для проведения отделки;
- завершение монтажа различных технических систем (водопровода, отопления, вентиляции, лифта);
- фундаменты для последующего монтажа технологического оборудования.
Иногда, если это предусмотрено договором подряда, проводится промежуточная оплата работ. В таких случаях ежеквартально организовывается сдача-приемка произведенных работ для установления их объема и необходимой суммы оплаты.
Каждая промежуточная проверка проводится комиссионно с участием уполномоченных лиц от строительных, проектных организаций и органов государственного надзора. Заказчик также имеет право на промежуточный контроль. Каждая контрольная проверка актируется в установленном порядке. Весь процесс капитального строительства завершается окончательной приемкой объекта сначала от генподрядчика рабочей комиссией застройщика, а затем от застройщика государственной приемочной комиссией.
Если же речь идет о смонтированных сложных технических средствах, то тогда под промежуточной приемкой подразумевается проверка оборудования без подачи электрического напряжения и определяется степень готовности его к наладочным работам.
Окончательной приемкой считается определение готовности технических средств к работе в эксплуатационном режиме после проведения полноценных индивидуальных и комплексных испытаний.
Окончательной проверке также могут подвергаться такие объекты:
- тепловые пункты и отопительные системы;
- газопроводы;
- электрозащитные устройства;
- производственные мощности;
- резервуары;
- котлы;
- детали, измерительные приборы и т.д.
Проведение различного вида четко регламентированных приемочных работ в строительстве и на производстве значительно снижает риск изготовления недоброкачественной продукции или возведения строения, которые могут представлять угрозу для жизни, здоровья и имущества граждан, а также для окружающей природной среды.
Источник: finswin.com
Обращение медицинских изделий в розничных фармацевтических сетях
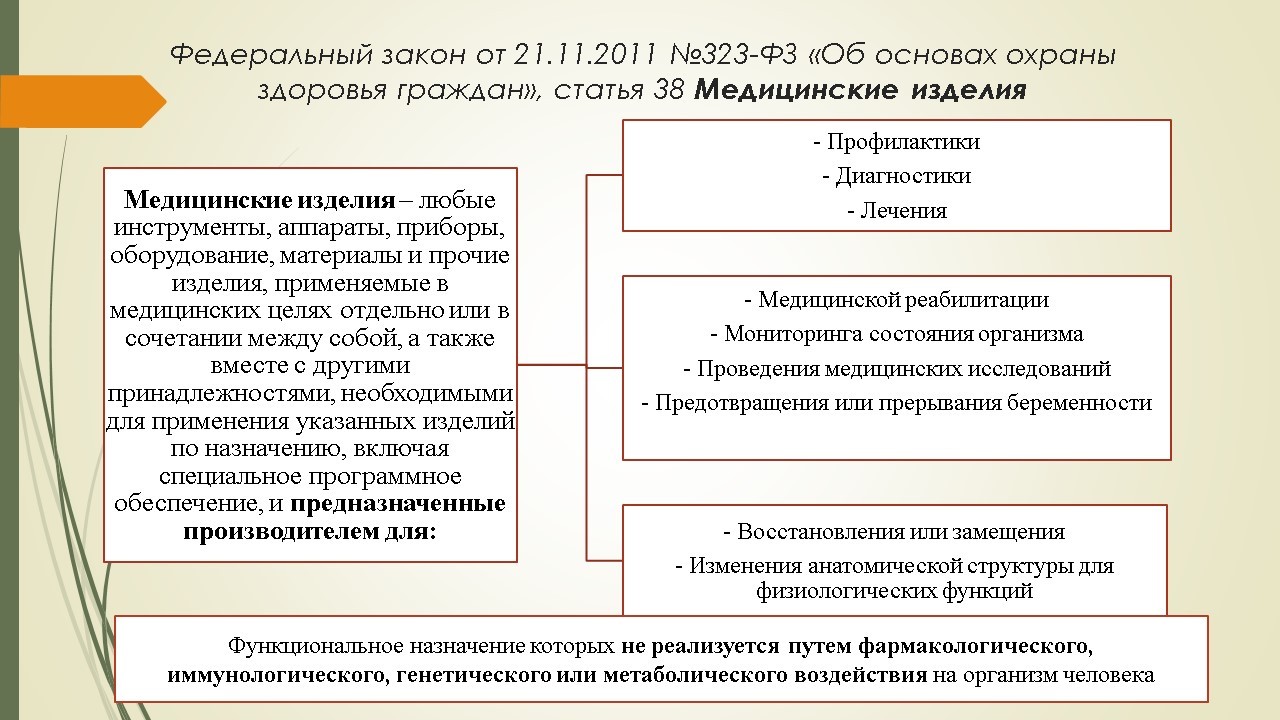
На данный момент, к сожалению, нет единого Федерального закона, который регулировал бы обращение медицинских изделий. Тем не менее, определение термину «медицинские изделия» дано в Федеральном законе №323-ФЗ «Об основах охраны здоровья граждан».
С 2016 года появился еще один нормативный документ, регламентирующий перечень нормативно-правовых актов, регулирующих оборот медицинских изделий, который используется при проведении проверок надзорным органом – Приказ Росздравнадзора №4043 «Об утверждении Перечня правовых актов и их отдельных частей (положений), содержащих обязательные требования, соблюдение которых оценивается при проведении мероприятий по контролю в рамках отдельного вида государственного контроля (надзора)». Нас интересуют пункт 3 и 11 данного Приказа. Для розничных фармацевтических организаций наиболее важным является пункт11, который содержит 19 нормативных актов (Федеральные законы, постановления Правительства, ведомственные приказы).
Пункт 3 предназначен для медицинских организаций, по своему составу содержит большую часть тех же нормативных актов, что и пункт 11 и при этом включает в себя особенности, касающиеся, например, организации клинических исследований, применения и эксплуатации.
На данный момент обращение медицинских изделий, как вид предпринимательской деятельности, требует предварительного уведомления Росздравнадзора, что регламентировано Постановлением Правительства РФ №584 «Об уведомительном порядке начала осуществления отдельных видов предпринимательской деятельности», а также Федеральным законом №294 «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»: уведомление представляется после государственной регистрации и постановки на учет в налоговом органе до начала фактического выполнения работ или предоставления услуг (может быть в форме электронного документа).
За непредоставление указанного уведомления предусмотрена административная ответственность в виде наложения штрафа на должностное лицо в размере от 3 до 5 тыс.р., на юридическое лицо – от 10 до 20 тыс.р. (ч. 1 ст. 19.7.5 КоАП РФ).
Однако следует отметить, что предоставлять данное уведомление обязаны только те розничные фармацевтические организации, которые стали заниматься указанным видом деятельности позднее 18 декабря 2014 года (те, кто начал свою деятельность до указанной даты, освобождаются от уведомления).
Рассмотрим нормативно-правовое регулирование обращения медицинских изделий в разрезе основных процессов, которые происходят в розничной фармацевтической организации от момента поступления медицинского изделия до момента реализации конечному потребителю (отпуска) или уничтожения.
1. Приемка медицинских изделий.
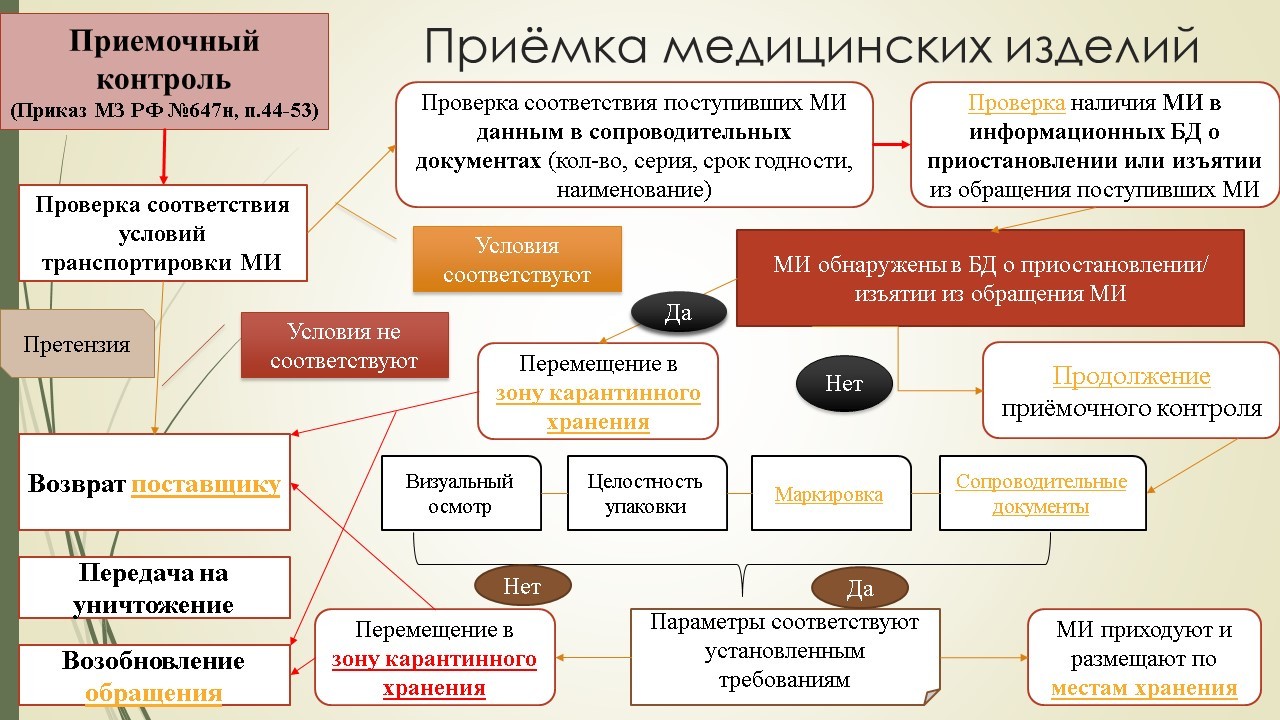
Сама схема приемки медицинских изделий укладывается в общую схему приемки всех товаров аптечного ассортимента. Основные моменты, касающиеся порядка проведения приемочного контроля изложены в Приказе 647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». Весь процесс начинается с проверки соблюдения условий транспортировки, соответствия поступивших медицинских изделий данным в сопроводительных документах (очень важно в данном случае проверить наличие их в информационных базах данных о приостановлении или изъятии из обращения медицинских изделий).
После проверки наличия поступивших медицинских изделий в указанных информационных базах данных и выявления положительного результата необходимо переместить медицинское изделие в зону карантинного хранения. При отрицательном результате приемочный контроль продолжается и будет состоять из следующих стадий: контроль качества, визуальный осмотр, целостность упаковки, маркировка и проверка сопроводительной документации.
Если по перечисленным параметрам медицинское изделие соответствует установленным требованиям, оно приходуется и размещается на основное место хранения; если нет – перемещается в зону карантинного хранения и либо возвращается поставщику (на условиях, прописанных в договоре) и уничтожается, либо возвращается в обращение (если поступила информация о возобновлении обращения).
Рассмотрим подробнее информационные базы данных о фальсифицированных, контрафактных и недоброкачественных медицинских изделиях.
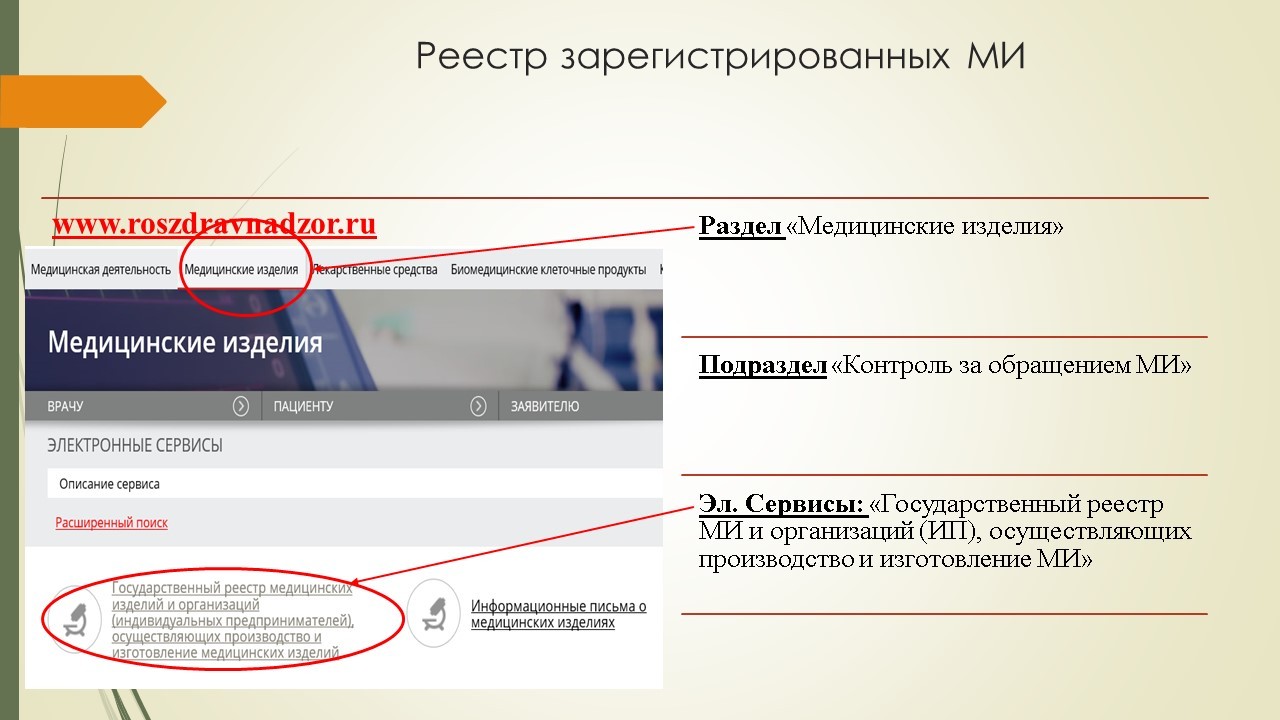
На официальном сайте Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор) есть раздел «Медицинские изделия» (подраздел «Контроль за обращением медицинских изделий», электронный сервис «Информационные письма о медицинских изделиях»).
Если на этом этапе выясняется наличие медицинского изделия в базе данных, согласно Федеральному закону №323 «Об основах охраны здоровья граждан» оно не имеет права реализовываться и в дальнейшем фальсифицированные и недоброкачественные медицинские изделия подлежат изъятию и уничтожению или вывозу, а контрафактные – изъятию и только последующему уничтожению.
Порядок уничтожения регламентирован Постановлением Правительства №1360 «Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий».
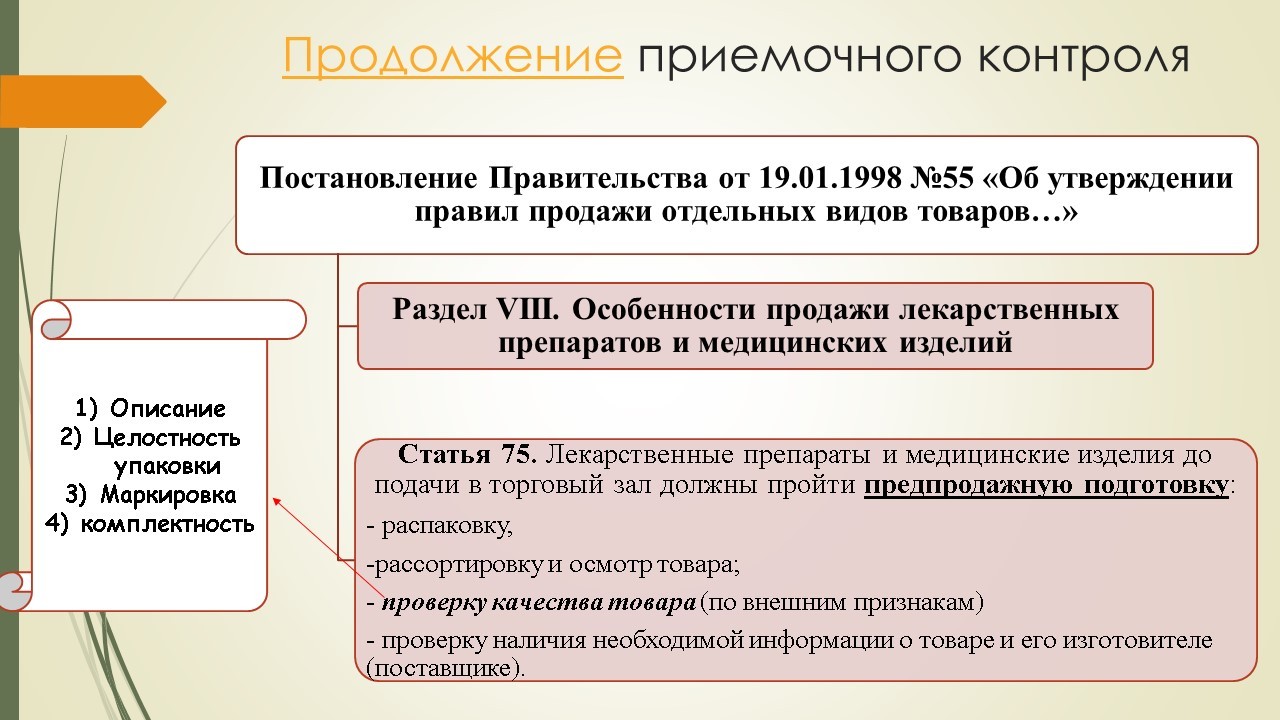
Что касается приемочного контроля, перечень манипуляций, которые необходимо провести до момента передачи изделия на место постоянного хранения, изложен в Постановлении Правительства №55 «Об утверждении правил продажи отдельных видов товаров…». Согласно статье 75 данного Постановления, медицинские изделия до подачи в торговый зал должны пройти предпродажную подготовку:
— распаковку;
— рассортировку и осмотр товара;
— проверку качества товара (по внешним признакам: описание, целостность упаковки, маркировка, комплектность);
— проверку наличия необходимой информации о товаре и его изготовителе (поставщике).
Один из параметров качества медицинского изделия – маркировка (именно этот параметр требует особого разъяснения, так как на данный момент нет единого нормативного документа, который содержал бы совокупную информацию о том, какая маркировка на медицинских изделиях должна быть).
Первый нормативный документ, регламентирующий маркировку – Постановление Правительства №1037 «О мерах по обеспечению наличия на ввозимых на территорию РФ непродовольственных товарах информации на русском языке», который говорит о том, что все ввозимые на территорию Российской Федерации и предназначенные для дальнейшей реализации медицинские изделия должны содержать определенный перечень данных на русском языке, а также указывает, где данная информация должна присутствовать.
Так как Российская Федерация входит в Таможенный Союз, необходимо помнить о документах, регламентирующих его деятельность: Решение Комиссии Таможенного союза от №299 «О применении санитарных мер в таможенном союзе», в котором также присутствует информация о требованиях к маркировке.
В настоящее время активно создается нормативная база обращения медицинских изделий в рамках Евразийского экономического союза. Основным документом является «Соглашение о единых принципах и правилах обращения медицинских изделий (изделий медицинского назначения и медицинской техники)» (Заключено в г. Москве 23.12.2014), согласно которому медицинские изделия, прошедшие установленные в рамках Союза процедуры регистрации и подтверждения соответствия общим требованиям безопасности и эффективности медицинских изделий, требованиям к внедрению и поддержанию системы менеджмента качества медицинских изделий, перед выпуском в обращение в рамках Союза подлежат обязательной маркировке специальным знаком обращения медицинского изделия на рынке Союза; данный знак был утвержден в 2016 году Решением Совета Евразийской экономической комиссии N 26 «О специальном знаке обращения медицинских изделий на рынке Евразийского экономического союза».
Также хотелось бы обратить внимание на ряд других документов, в соответствии с которыми осуществляется обращение медицинских изделий в рамках Евразийского экономического союза:
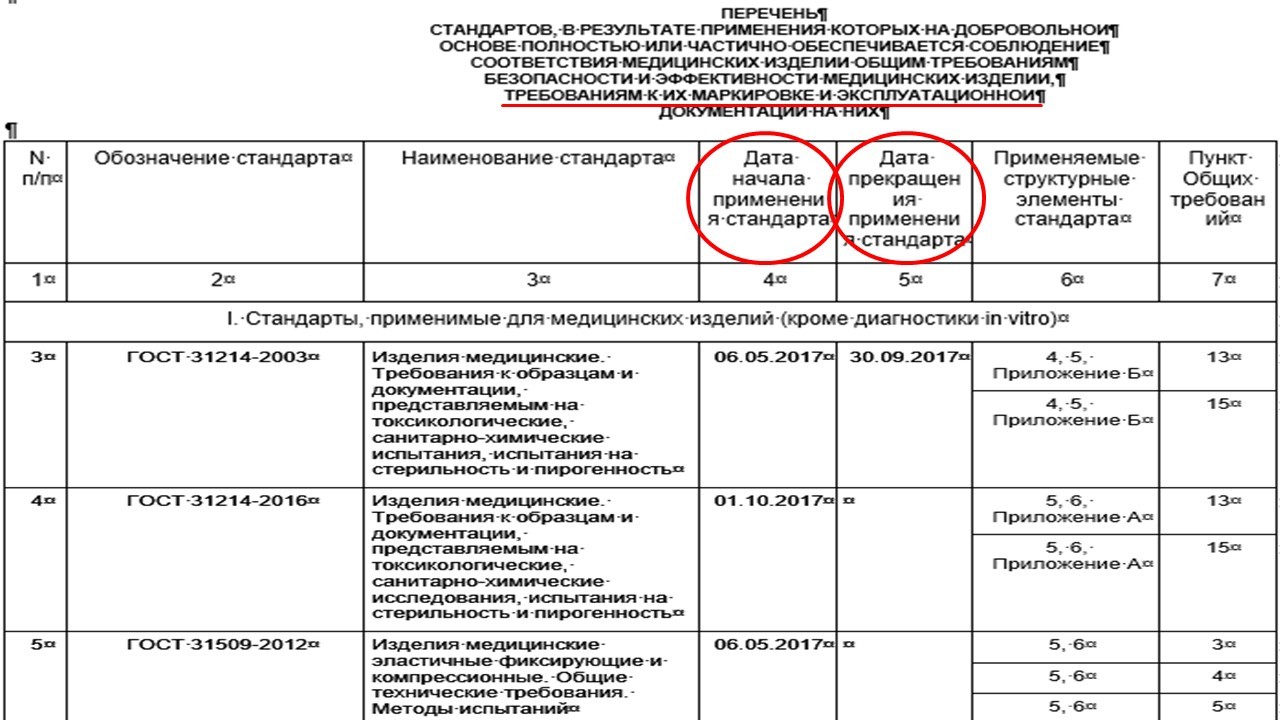
Что касается Рекомендаций Коллегии Евразийской экономической комиссии №17, в приложении к данному документу указан перечень стандартов (ГОСТ), в результате применения которых на добровольной основе полностью или частично обеспечивается соблюдение соответствия медицинских изделий общим требованиям безопасности и эффективности медицинских изделий, требованиям к их маркировке и эксплуатационной документации на них, а также дата начала применения стандарта и дата прекращения.
Также хотелось бы обратить внимание на еще один документ — Решение Совета Евразийской экономической комиссии №30, который посвящен порядку формирования и ведения единой информационной системы в сфере обращения медицинских изделий. В п. 14 Раздела II документа присутствует информация о перечне сведений, которые должны быть указаны в данной информационной системе:
«Единый реестр содержит следующие сведения:
у) изображение маркировки медицинского изделия (в электронном виде)»
Далее рассмотрим нормативные акты, регламентирующие сопроводительные документы к медицинским изделиям.
В целом данные нормативные акты можно разделить на две группы:
— касающиеся порядка регистрации информации, которая должна присутствовать и которую мы должны предоставлять потребителю;
— касающиеся подтверждения соответствия поступающих медицинских изделий.
Согласно Постановлению Правительства №55 «Об утверждении Правил продажи отдельных видов товаров…», на медицинское изделие должна быть предоставлена информация о номере и дате регистрационного удостоверения.
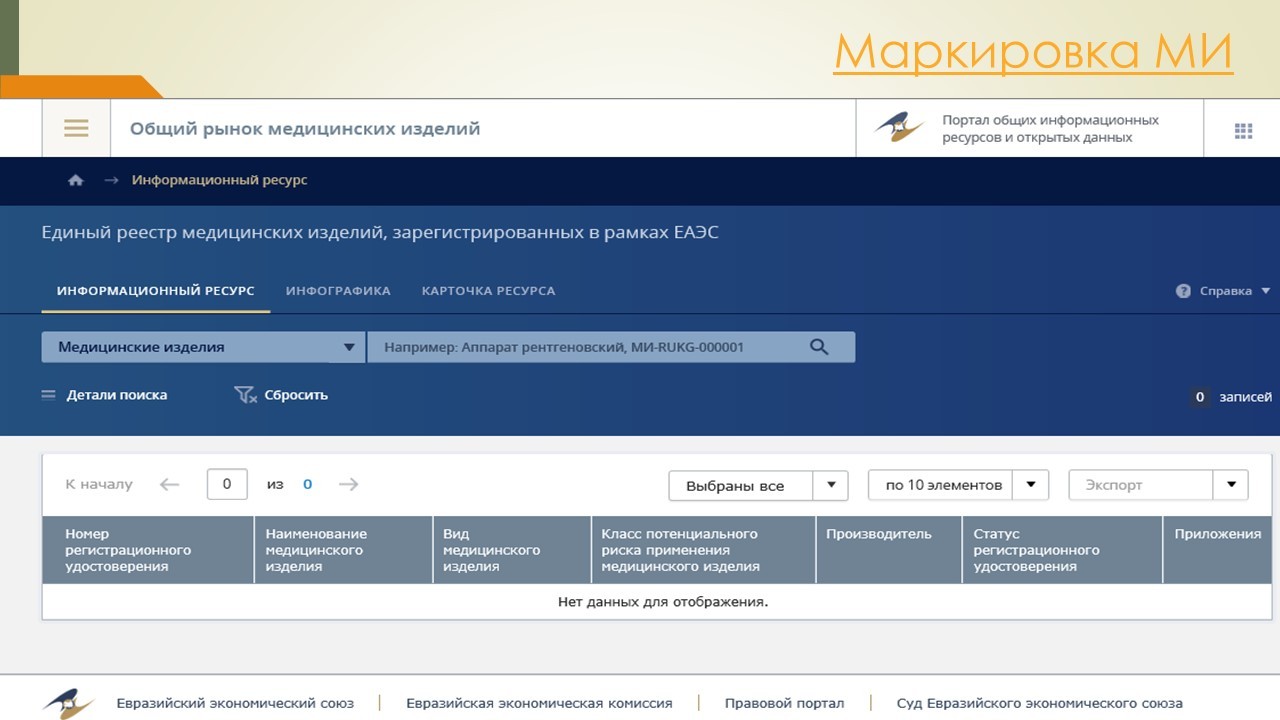
В соответствии со ст. 38 Федерального закона №323 «Об основах охраны здоровья граждан» на территории РФ запрещается реализация медицинских изделий, не зарегистрированных в установленном порядке; исключением являются медицинские изделия, изготовленные по индивидуальному заказу. Порядок регистрации утвержден Постановлением Правительства №1416 «Об утверждении правил государственной регистрации МИ», согласно которому процесс регистрации осуществляется Росздравнадзором, а документом, подтверждающим факт регистрации, является регистрационное удостоверение (выдающееся на данный момент бессрочно).
Найти информацию о регистрационном удостоверении на конкретное медицинское изделие можно на сайте Росздравнадзора в разделе «Медицинские изделия», подразделе «Контроль за обращением медицинских изделий», электронный сервис «Государственный реестр медицинских изделий и организаций (ИП), осуществляющих производство и изготовление медицинских изделий».
Следует помнить, что регистрационные удостоверения, имеющие ограниченный срок действия и выданные до момента вступления в силу Постановления Правительства №1416 «Об утверждении правил государственной регистрации МИ», действуют до истечения их срока действия.
Регистрационные удостоверения бессрочного действия, выданные до дня вступления в силу настоящего постановления, действительны и подлежат замене до 1 января 2021 г. на регистрационные удостоверения нового образца.
Что касается подтверждения соответствия медицинских изделий, оно может быть в виде декларирования соответствия или обязательной сертификации. Конкретные виды медицинских изделий, которые подлежат либо декларированию либо обязательной сертификации можно найти в Постановлении Правительства РФ N 982 «Об утверждении единого перечня продукции, подлежащей обязательной сертификации, и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии».
Обязанность проходить процедуру соответствия возложена ст. 28 Федерального закона № 184-ФЗ «О техническом регулировании».
Заявитель обязан:
— обеспечивать соответствие продукции требованиям технических регламентов;
— выпускать в обращение продукцию, подлежащую обязательному подтверждению соответствия, только после осуществления такого подтверждения соответствия;
— указывать в сопроводительной документации сведения о сертификате соответствия или декларации о соответствии;
— предъявлять в органы государственного контроля (надзора) за соблюдением требований технических регламентов, а также заинтересованным лицам документы, свидетельствующие о подтверждении соответствия продукции требованиям технических регламентов (декларацию о соответствии, сертификат соответствия или их копии) либо регистрационный номер сертификата соответствия или декларации о соответствии.
Заявитель — физическое или юридическое лицо, которое для подтверждения соответствия принимает декларацию о соответствии или обращается за получением сертификата соответствия, получает сертификат соответствия.
Информация, которая должна быть указана в товарно-сопроводительных документах, регламентирована Постановлением Правительства РФ №55 «Об утверждении Правил продажи отдельных видов товаров…»:
— о декларации (регистрационный № декларации, срок её действия, наименование организации, принявшей декларацию и орган, её зарегистрировавший);
— о сертификате (№ сертификата, срок его действия и орган, выдавший сертификат).
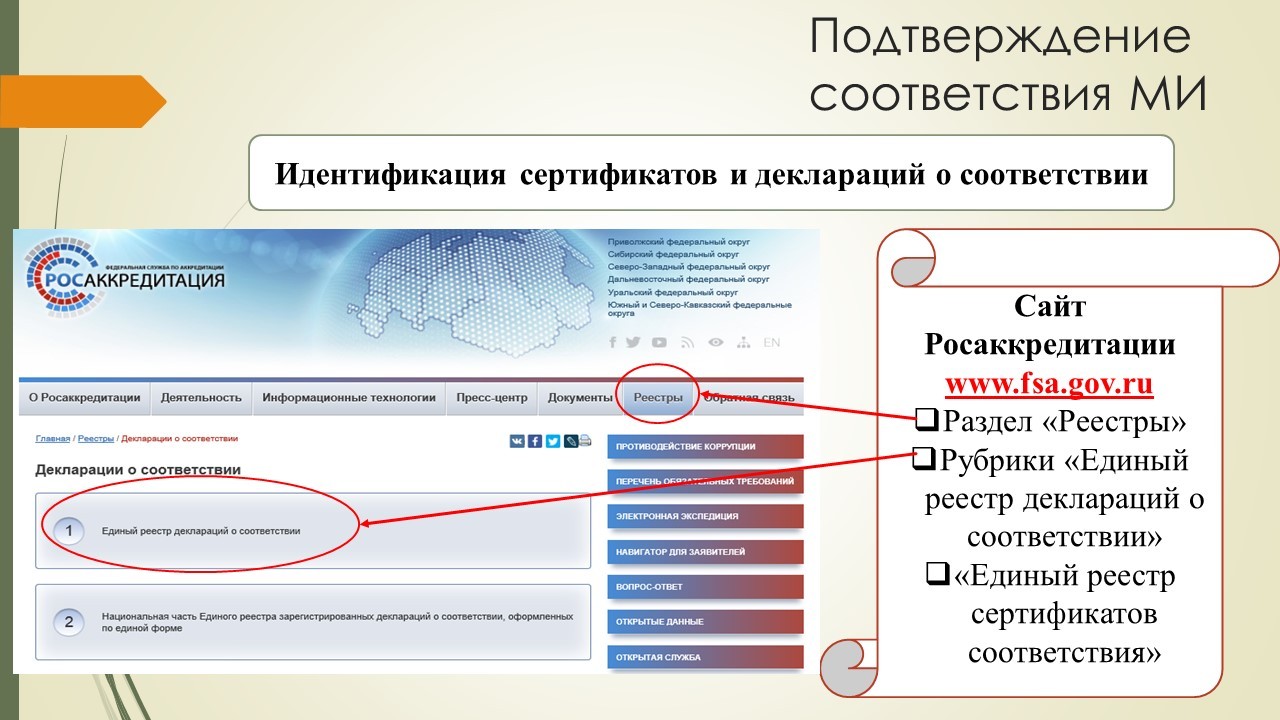
Посмотреть наличие действующей декларации/сертификата можно на сайте РосАккредитации в разделе «Реестры» в рубрике «Единый реестр деклараций о соответствии» либо «Единый реестр сертификатов соответствия».
Следует обратить внимание на то, какой существенный штраф предусмотрен за несоблюдение данного требования: согласно ст. 14.45 КоАП РФ, реализация продукции, подлежащей обязательному подтверждению соответствия, без указания в сопроводительной документации сведений о сертификате соответствия или декларации о соответствии, влечет наложение административного штрафа на должностных лиц в размере от двадцати тысяч до сорока тысяч рублей; на юридических лиц — от ста тысяч до трехсот тысяч рублей.
Также следует обратить особое внимание на то, что копии декларации/сертификата, если поставщик не является их держателем, не несут в себе юридической силы и являются лишь информационными листами. Поэтому следует добиваться от поставщика указания в сопроводительной документации данных сведений (в официальном документе, с печатью и подписью).
Согласно ст. 37 Федерального закона №184-ФЗ «О техническом регулировании», изготовитель (исполнитель, продавец, лицо, выполняющее функции иностранного изготовителя), которому стало известно о несоответствии выпущенной в обращение продукции требованиям технических регламентов, обязан сообщить об этом в орган государственного контроля (надзора) в соответствии с его компетенцией в течение десяти дней с момента получения указанной информации.
2. Хранение медицинских изделий.
После осуществления приемочного контроля необходимо разместить медицинские изделия на места их хранения. Хранение медицинских изделий регламентировано Приказом Минздрава РФ №377 «Об утверждении Инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения». Стоит обратить внимание, что данный Приказ не входит в перечень нормативных документов, по которому осуществляет проведение контролирующих мероприятий Росздравнадзор.
Но интересен тот факт, что в перечне поверочных листов, которые утверждены Приказом Росздравнадзора N 10449 «Об утверждении форм проверочных листов (списков контрольных вопросов), используемых Федеральной службой по надзору в сфере здравоохранения и ее территориальными органами при проведении плановых проверок при осуществлении государственного контроля за обращением медицинских изделий» в приложении №7 присутствует вопрос №8, звучащий следующим образом: «Осуществляется ли хранение у проверяемой организации в соответствии с разработанной производителем технической и (или) эксплуатационной документацией?», из чего можно сделать вывод, что для проверяющих все-таки основными требованиями, соблюдение которых будет контролироваться, являются требования тех.документации или эксплуатационной документации, обозначенные производителем данного медицинского изделия.
3. Реализация медицинских изделий.
Согласно Приказу № 1181Н «Об утверждении порядка назначения и выписывания медицинских изделий, а также форм рецептурных бланков, на медицинские изделия и порядка оформления указанных бланков, их учета и хранения», утверждены три формы рецептурных бланков на медицинские изделия.
Что касается реализации медицинских изделий, являющихся средствами измерения, в приложении 2 Приказа МЗ РФ №89 «Об утверждении Порядка проведения испытаний в целях утверждения типа средств измерений, а также Перечня медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, в отношении которых проводятся испытания в целях утверждения типа средств измерений» указаны наименования медицинских изделий, относящиеся к средствам измерений.
В соответствии со ст. 13 Федерального закона №102-ФЗ ««Об обеспечении единства измерений», средства измерений, предназначенные для применения в сфере государственного регулирования обеспечения единства измерений, до ввода в эксплуатацию, а также после ремонта подлежат первичной поверке, а в процессе эксплуатации — периодической поверке.
Применяющие средства измерений юридические лица и индивидуальные предприниматели обязаны своевременно представлять эти средства измерений на поверку.
Иногда возникают вопросы, касающиеся тонометров, лежащих на хранении, у которых прошел межповерочный интервал: необходимо ли проводить для них повторную поверку?
Согласно Приказу Минпромторга России №1815 «Об утверждении Порядка проведения поверки средств измерений, требования к знаку поверки и содержанию свидетельства о поверке», периодической поверке подвергается каждый экземпляр средств тзмерений, находящийся в эксплуатации, через установленный межповерочный интервал. Средства измерения, введенные в эксплуатацию и находящиеся на длительном хранении (более одного межповерочного интервала), подвергаются периодической поверке только после окончания хранения.
При вводе в эксплуатацию средства измерения после длительного хранения (более одного межповерочного интервала) проводится периодическая поверка.
Поскольку процесс отпуска все-таки не относится к понятию ввода в эксплуатацию, вопрос о необходимости поверки средства измерения перед отпуском остается открытым.
4. Возврат медицинских изделий от потребителя.
Что касается возврата медицинских изделий, согласно Постановлению Правительства №55 «Об утверждении Правил продажи отдельных видов товаров…», если медицинские изделия надлежащего качества, возврату они, как и лекарственные средства, не подлежат.
В случае отпуска некачественных медицинских изделий, согласно ст. 18 Закона РФ N 2300-1 «О защите прав потребителей», продавец обязан принять товар ненадлежащего качества у потребителя и в случае необходимости провести проверку качества товара. Потребитель вправе участвовать в проверке качества товара.
Однако если в результате экспертизы товара установлено, что его недостатки возникли вследствие обстоятельств, за которые не отвечает продавец, потребитель обязан возместить продавцу расходы на проведение экспертизы, а также связанные с ее проведением расходы на хранение и транспортировку товара.
Кроме того существуют определенные ограничения при продвижении медицинских изделий, также как и лекарственных препаратов: согласно ст. 74 Федерального закона от №323-ФЗ «Об основах охраны здоровья граждан», фармацевтические работники и руководители аптечных организаций не вправе:
— получать от компании, представителя компании образцы лекарственных препаратов, медицинских изделий для вручения населению;
— заключать с компанией, представителем компании соглашения о предложении населению определенных лекарственных препаратов, медицинских изделий;
— предоставлять населению недостоверную и (или) неполную информацию о наличии лекарственных препаратов, включая лекарственные препараты, имеющие одинаковое международное непатентованное наименование, медицинских изделий, в том числе скрывать информацию о наличии лекарственных препаратов и медицинских изделий, имеющих более низкую цену.
5. Налогообложение при реализации медицинских изделий.
В соответствии со ст. 164 п. 2 пп . 4 Налогового Кодекса Российской Федерации, налог на добавленную стоимость составляет 10%, за исключением медицинских изделий, утвержденных Постановлением Правительства РФ №1042 «Об утверждении перечня медицинских товаров, реализация которых на территории Российской Федерации и ввоз которых на территорию Российской Федерации и иные территории, находящиеся под ее юрисдикцией, не подлежат обложению (освобождаются от обложения) налогом на добавленную стоимость» (они освобождаются от налога на добавленную стоимость).
6. Регулирование ценообразования.
В ст. 80 Федерального закона №323-ФЗ « Об основах охраны здоровья граждан», утвержден перечень медицинских изделий, в отношении которых государством ведется регулирование ценообразования: предельные отпускные цены производителей и предельные размеры оптовых надбавок к фактическим отпускным ценам на медицинские изделия, включенные в утвержденный Правительством Российской Федерации перечень медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, подлежат государственному регулированию и определяются в порядке, установленном Правительством Российской Федерации №2229-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг».
7. Мониторинг безопасности медицинских изделий.
Что касается мониторинга безопасности медицинских изделий, необходимость его проведения изложена в ст. 96 Федерального закона №323-ФЗ « Об основах охраны здоровья граждан», но основной порядок утвержден Приказом Минздрава №175н «Об утверждении Порядка осуществления мониторинга безопасности медицинских изделий».
Источник: provizor24.ru