Только медь и драгоценные металлы (золото, серебро, платина и т. д.) встречаются в природе в их реальном металлическом состоянии. Все другие металлы (включая железо) перерабатываются из минералов или руд в металлы, которые по своей природе нестабильны в окружающей их среде. Все искусственные металлы нестабильны и имеют тенденцию превращаться в более стабильные минеральные формы. Некоторые металлы образуют на своей поверхности защитные керамические пленки (пассивные пленки), которые предотвращают или замедляют процесс коррозии. Металлы подвержены коррозии, потому что они используются в среде, где они химически нестабильны.
Зная разницу между коррозией и ржавчиной
Коррозия — постепенное разложение металлов в результате химической реакции с окружающей средой.
Металл вступает в реакцию с внешней средой и со временем может ухудшить полезные свойства материалов и конструкций, включая прочность, внешний вид и проницаемость для жидкостей и газов. Это повреждение известно, как коррозия. При воздействии внешней среды металлы окисляются и вступают в реакцию с кислородом атмосферы.
Коррозия металла. Химия – Просто
К внешним факторам, вызывающим коррозию металлов, относятся вода, кислоты, щелочи, соли, масла и другие твердые и жидкие химические вещества. Металлы также подвергаются коррозии при воздействии газообразных материалов, таких как пары кислоты, газообразный формальдегид, газообразный аммиак и серосодержащие газы.
Два места, где имеют место катодная реакция и анодная реакция, могут быть близко друг к другу или далеко друг от друга в зависимости от обстоятельств. Некоторые материалы устойчивы к коррозии, а другие – подвержены ей. Однако коррозию можно предотвратить некоторыми методами. Покрытие – один из методов защиты материалов от коррозии. Сюда входит покраска, гальваника, нанесение эмали на поверхность и т. д.
Ржавчина — форма коррозии, но конкретно относится к окислению железа или его сплавов.
Только металлы, содержащие железо или его сплавы, могут ржаветь, поскольку этот термин конкретно относится к окислению железа (как в самом железе, так и в стали) или к оксиду железа, который образуется. Для появления ржавчины должны быть определенные условия. В присутствии кислорода, влаги или воды, железо подвергается этой реакции и образует серию оксидов железа. Этот красновато-коричневый цвет известен как ржавчина. Если ржавчина начинается в одном месте, она в конечном итоге распространяется и весь металл распадается.
Наиболее частая причина – длительное пребывание в воде. Любой металл, содержащий железо, включая сталь, будет связываться с атомами кислорода, содержащимися в воде, с образованием слоя оксида железа или ржавчины. Ржавчина усилится и ускорит процесс коррозии, поэтому уход за ней очень важен.
Ржавчина бывает разных форм, наиболее распространенной из которых является красная ржавчина, образованная красными оксидами. Хлор в воде вызывает образование зеленой ржавчины. Как и большинство коррозионных процессов, ржавление происходит постепенно. Через некоторое время, если материал не обработать, он распадется, и все превратится в ржавчину, сделав его непригодным для использования.
Как избавится от Ржавчины и Коррозии НАВСЕГДА | Как спасти металл
Другие металлы
Когда алюминий корродирует, на поверхности металла образуется тонкий слой оксида алюминия, который действует как защитный барьер. Этот барьер не отслаивается, как ржавчина, что предотвращает дальнейшую коррозию алюминия в будущем.Поскольку медь корродирует, она приобретает зеленый цвет, известный как патина. Эта патина желательна, поскольку она не только создает защитный барьер для дальнейшей коррозии, но и имеет внешний вид, который нравится потребителям.

Рекомендуем эффективный состав для удаления ржавчины с металлов — «РжавоМед-У»
Источник: blog.perhim.ru
Ржавчина и коррозия

Многие, не очень осведомленные в делах короззии граждане считают, что коррозия и ржавчина – это одно и то же. Но, на самом деле, это два совсем разных понятия, и отличаются они во многом.
Начнем с того, что коррозия может быть не только у металла, а и у многих других материалов (например, бетона или пластмассы). Конечно, чаще всего мы встречаемся именно с коррозией металла, но в других случаях нужно уточнять, говоря «коррозия металла»; коррозия, – это процесс разрушения материалов, который вызван разнообразными химическими (а также и электрохимическими) процессами
Конечно, коррозией это считается в тех случаях, если данные процессы вызваны воздействием окружающей среды. Но не обязательно этим материалом должен быть металл.
Также коррозия металла подразумевает не только ржавление. Согласно международным стандартам, коррозия металла это химическое (в некоторых случаях физико-химическое) явление, возникающее между металлом и средой, которой приводит к тому, что свойства металла и его структура понемногу ухудшаются и разрушаются. Но не всегда результатом коррозии является ржавчина.
Под ржавчиной следует понимать слой оксидов железа, которые прошли частичное гидратирование, и образовали на поверхности металла этот самый слой. Обычно он имеет красно-желтые оттенки, сначала образуется в форме крупинок, а потом – в форме больших пятен, при длительном ржавлении с слоях металла могут появляться отверстия.
Поэтому необходимо постоянно следить даже за малейшими проявлениями ржавчины, проводить профилактику, очистку фасадов и оборудования.
Одно из наиболее важных отличий коррозии от ржавчины: коррозия это процесс, а ржавчина это его результат. Коррозию предотвращают, пытаются обезопасить металлические конструкции от ее проявления.
А вот ржавчина – это результаты проявления коррозии, которой не удалось избежать, либо если для профилактики коррозии не принималось никаких необходимых мер. Для избавления от ржавчины используют бластинг, пескоструйную очистку, или другие методы.
Не стоит также путать коррозию с эрозией – это похожие по звучанию, но совсем разные по сути термины. Эрозия – разрушение металла под влиянием механических и других воздействий, таких как дождь, ветер, пыль и тому подобные явлений. Общее между коррозией и эрозией только то, что обе являются термином для обозначение физического разрушения материала.
Источник: vecfort.ru
Коррозия металлических конструкций. Коррозия каменных конструкций.
По своей природе различают коррозию химическую и электрохимическую. Химическая коррозия возник: в результате непосредственного воздействия на металл aгpeccивных жидкостей или газов. Электрохимическая коррозия вызывается воздействием влаги и атмосферы на поверхностный слой металла. Коррозия приводит к уменьшению поперечного сечения несущей способности элементов конструкций. Скорость коррозии зависит от степени агрессивности окружающей среды и от фор поперечных сечений конструкций. Скопление пыли на поверхности и периодическое ее смачивание увеличивают скорость коррозии
Коррозионное разрушение металла является одной из существенных причин потери работоспособности и снижения долговечности металлических конструкций. Коррозией металлов называется окислительно-восстановительный процесс разрушения металлов и сплавов в результате химического или электрохимического взаимодействия с окружающей средой, происходящий на поверхности раздела фаз. Более всего от коррозии страдают железо и его сплавы, а также алюминий. Металлические конструкции подвержены в основном электрохимической коррозии, возникающей при соприкосновении металлов с электролитами.
При оценке технического состояния конструкций, пораженных коррозией, необходимо прежде всего определить вид коррозии. Это дает возможность сузить интервал поиска основных причин коррозионного повреждения конструкций, более точно определить влияние коррозионного повреждения на несущую способность элементов конструкций, а также разработать наиболее обоснованные мероприятия по восстановлению несущей способности и защите конструкций от коррозии.
По характеру поражения металла различают сплошную (общую) и локальную коррозию.
Сплошная коррозия в свою очередь может быть равномерной и неравномерной в зависимости от глубины поражения на различных участках поверхности. Если при коррозии нарушается одна структурная составляющая сплава (графитизация чугуна) или один из компонентов сплава, то коррозию называют структурно-избирательной (рис. 2.1).
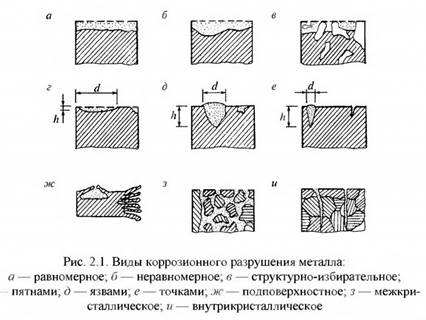
Сплошная коррозия характерна для стали, алюминия, цинковых и алюминиевых защитных покрытий в любых средах, в которых коррозионная стойкость данного материала или металла покрытия недостаточна. Этот вид коррозии характеризуется относительно равномерным по всей поверхности постепенным проникновением вглубь металла, то есть уменьшением толщины сечения элемента или толщины защитного слоя металлического покрытия. При коррозии в нейтральных, слабощелочных и слабокислых средах элементы конструкции покрываются видимым слоем продуктов коррозии, после механического удаления которого до чистого металла поверхность конструкций оказывается шероховатой, но без видимых язв, точек коррозии и трещин. При коррозии в кислых (а для цинка и алюминия и в щелочных) средах видимый слой продуктов коррозии может не образовываться Общей коррозии наиболее подвержены, как правило, поверхности в узких щелях, зазорах и на участках скопления пыли и влаги.
Наиболее опасны межкристаллитная и транскристаллитная коррозии (рис. 2.1,з, и). Первая проходит по наименее стойким границам зерен, не затрагивая зерен металла. Вторая — рассекает зерна металла, проходя через них трещиной. Межкристаллитной коррозии подвержены многие сплавы: строительные стали, нержавеющие высокохромистые и хромоникелиевые стали, дюралюминиевые сплавы и др.
Межкристаллитная коррозия характеризуется относительно равномерным распределением множественных трещин на больших участках поверхности конструкций. Под оптическим микроскопом на поперечных шлифах, изготавливаемых из отобранных проб, видно, что трещины распространяются только по границам зерен металла.
Аналогичные признаки имеет коррозионная усталость — вид квазихрупкого разрушения материалов при одновременном воздействии циклических напряжений и жидких агрессивных сред. Об интенсивности коррозионной усталости судят по числу циклов до зарождения трещин или по скорости роста наиболее длинных трещин.
Основным фактором, влияющим на развитие коррозии, служит атмосферная среда. Показателями, определяющими степень агрессивности среды, являются: относительная влажность, температура, возможность образования конденсата, состав и концентрация газов и пыли, туманы агрессивных жидкостей.
В зависимости от условий эксплуатации конструкции могут находиться под воздействием общезаводской атмосферы и внутрицеховой. Особенно неблагоприятным фактором является относительная влажность. Наибольшая скорость коррозии реализуется при периодическом выпадении конденсата, однако она резко возрастает уже при достижении так называемой критической влажности — для стали 70. 75 %. При наличии продуктов коррозии на поверхности конструкций критическая влажность снижается до 50. 60 %.
Степень коррозионного износа определяют измерением толщины тщательно очищенного от продуктов коррозии прокатного профиля. Измерения осуществляют с помощью скобы с индикатором часового типа с ценой деления 0,01 мм. Замеры должны быть произведены в 10—20 местах по длине элемента для получения достоверного результата надо сделать около 200 замеров однотипных элементов.
Своевременная защита от коррозии металлических конструкций в процессе эксплуатации — одно из главных условий долговечности и надежности сооружений. Наиболее распространенным и достаточно эффективным средством для защиты металлоконструкций от коррозии являются лакокрасочные (органические) покрытия — высокомолекулярные пленки естественного и искусственного происхождения. Физико-химическую основу лакокрасочных материалов составляют многокомпонентные системы, содержащие пленкообразующие вещества, растворители, пигменты и добавки различного назначения. Лакокрасочное покрытие должно быть сплошным, беспористым, газо- и водонепроницаемым, химически стойким, эластичным, обладать хорошей адгезией и механической прочностью.
В зависимости от рода пленкообразующего вещества лакокрасочные материалы подразделяются на масляные, битумные, глифталевые, перхлорвиниловые, эпоксидные и др. В большинстве случаев материал наносится на предварительные слои грунтовки и шпатлевки, обычно в несколько покрывных слоев. Выбор типа лакокрасочного материала зависит от степени агрессивности эксплуатационной среды и определяется нормативными документами
При восстановлении защитных покрытий большое значение имеет подготовка поверхности элементов под окраску. Перед нанесением покрытия поверхность очищается механическим или химическим способом от ржавчины, старой краски, жировых и других загрязнений до степени 1 (ГОСТ 9.402-80*).
К механическим способам относятся пескоструйная и дробеструйная очистка, обработка поверхности механизированным инструментом. При пескоструйной очистке применяется специальный порошок (металлический песок), расход которого примерно в 10 раз меньше по сравнению с обычным кварцевым песком. Запыленность воздуха ниже допустимой по требованиям санитарных норм.
Такие же преимущества имеет и дробеструйная очистка. Применяется гидропескоструйный способ очистки, осуществляемый эжектором, подающим струю воды с песком. Для предотвращения коррозии металлической поверхности в воду добавляют -1,6 % замедлителя коррозии (ингибитора). Возможна очистка пневматическими или электрическими инструментами.
· Коррозия каменных конструкций.
Коррозия — это разрушение материалов строительных конструкций под воздействием окружающей среды, сопровождающееся химическими, физико-химическими и электрохимическими процессами.
По механизму протекания различают физическую, химическую и биологическую коррозию. Вид коррозийных процессов зависит от местоположения конструктивного элемента и характера среды. Так, подземные конструкции могут подвергаться всем видам коррозии: надземные – преимущественно физической, реже – химической коррозии.
Химическая коррозия сопровождается необратимыми изменениями материала конструкций в результате взаимодействия с агрессивной средой.
Электрохимическая коррозия возникает в металлических конструкциях в условиях неблагоприятных контактов с атмосферной средой, водой, влажными грунтами, агрессивными газами.
Наибольшее влияние на износ конструкций оказывает водная среда. Поскольку большинство конструкций зданий (фундаменты, стены, перегородки, перекрытия и элементы крыш) выполнены из искусственных материалов с пористо-капиллярной структурой, при контакте с водой они интенсивно увлажняются.
В зависимости от вида связи с материалом различают химически связанную, адсорбционно-связанную, капиллярную и свободную влагу. Последняя заполняет крупные пустоты и поры материала и удерживается в них гидростатическими силами. Такая влага легко удаляется из материала конструкции при высушивании.
Влияние влаги на процесс разрушения конструкций неодинаковое. В одних случаях она как поверхностно-активное вещество ускоряет разрушение, в других, являясь хорошим растворителем, действует в качестве химически активной агрессивной среды.
На начало разрушения каменных конструкций указывают появляющиеся на поверхности конструктивного элемента белые высолы. Они свидетельствуют о том, что в материале происходит растворение солей материала и их вынос наружу в направлении миграции растворов более низких температур. Во многих случаях при отсутствии постоянного увлажнения карбонатная корка СаСО3 выполняет функцию защиты каменных конструкций. Опасны для каменных и бетонных конструкций воды, содержащие химически активные вещества.
Коррозия конструкций из силикатных материалов.
Разрушение пористых силикатных конструкций при наличии сообщающихся пор происходит не только на поверхности, но и в толще материала. В замкнутых, не сообщающихся друг с другом порах (например, в красном кирпиче мокрого прессования) разрушительное влияние агрессивных сред проявляется в более ограниченном масштабе, чем в открытых порах. Силикатные конструкции устойчивы к щелочным агрессивным средам. Благодаря наличию в воздухе и грунтовой воде веществ (оксидов, газов), образующих растворы кислот, во влажной среде силикатные изделия быстро разрушаются.
Разрушение кирпичных стен может происходить при периодическом увлажнении и высыхании, поэтому конструкции из кирпича наиболее интенсивно подвергаются химической и физической коррозии в систематически увлажняемых местах (фундаменты, стены подвалов, стены и кирпичные перегородки влажных помещений, карнизы, сандрики и другие элементы зданий, не защищенные от попадания влаги из атмосферных осадков).
Защита бетонных и железобетонных конструкций от коррозии должна предусматриваться, начиная со стадии проектирования сооружений и конструкций. Создавая проект сооружения, необходимо разработать мероприятия, которые обеспечат требуемую долговечность строительным конструкциям, т. е. необходимо осуществить проектирование защиты конструкций от коррозии. Проектирование защиты бетонных и железобетонных конструкций от коррозии следует начинать .с определения вида агрессивной среды, степени ее агрессивности и длительности воздействия, а затем на основании анализа установить вид защиты, произвести выбор материалов для ее осуществления, выработать конструктивные решения по защите и подобрать требуемые способы ее осуществления.
Различают два вида защиты бетонных и железобетонных конструкций от коррозии: первичная и вторичная.
Первичная защита от коррозии заключается в придании способности бетону и железобетону сопротивляться воздействию агрессивных сред посредством обеспечения оптимального их состава и структуры при изготовлении конструкций.
Вторичная защита от коррозии заключается в создании условий, ограничивающих или исключающих воздействие агрессивных сред на бетонные или железобетонные конструкции после их изготовления.
Первичную защиту следует проектировать путем выбора стойких составляющих бетона и железобетона, необходимых технологических параметров приготовления, уплотнения и твердения бетона, геометрической конфигурации конструкции, препятствующей образованию или уменьшению скопления агрессивных веществ на их поверхности, толщины защитного слоя бетона, обеспечения трещиностойкости конструкции и допустимого раскрытия трещин при эксплуатационных нагрузках. Первичная защита включает также нанесение защитного металлического, пленочного или лакокрасочного покрытия на поверхность арматуры. Металлические покрытия для защиты стальной арматуры, стальных закладных деталей и соединительных элементов железобетонных конструкций должны образовывать слой толщиной от 0,05 до 0,2 мм. В качестве материалов для покрытий следует применять алюминий или цинк. Защитные свойства металлических покрытий могут быть усилены посредством последующего нанесения на них лакокрасочных покрытий или полимерных материалов.
Вторичную защиту от коррозии следует проектировать в зависимости от требуемой химической стойкости, проницаемости, адгезии с защищаемой поверхностью, трещиностоикости и прочности путем выбора вида покрытий для защиты, материалов для защитной обработки или пропитки бетона, способов ее выполнения. Вторичную защиту от коррозии осуществляют путем пропитки бетона или нанесения лакокрасочного, пленочного, облицовочного или футеровочного защитного покрытия на поверхность бетонной или железобетонной конструкции с целью уплотнения поверхностного слоя бетона толщиной от 3 до 30 мм.
Источник: studopedia.ru
Способы борьбы с коррозией металлов

Коррозией металла называется нарушение его структуры в результате химических или электрохимических реакций. Это может приводить к разрушению деталей, конструкций, приводить к выходу из строя узлов автомобилей, станков, другого производственного оборудования, инструментов, трубопроводов и иных металлических изделий. Каждый год коррозия разрушает около 13 миллионов тонн металла.
Предотвратить и замедлить этот негативный процесс призваны меры антикоррозийной защиты металла. На это в мире тратится ежегодно более 2,5 триллионов долларов США, по данным NACE International. Как показывает практика, металлические изделия просто не способны служить без специальных защитных мер в течение длительного времени
Причины коррозии металлов
Виды коррозии металлов
В зависимости от того, какие именно реакции протекают на границе металла с окружающей средой, выделяют три основных вида коррозии.
- Химическая развивается, когда металл соприкасается с солями или сухими газообразными соединениями. Яркий пример – контакт днища кузова автомобиля с солью, которой зимой в России посыпают автодороги. На деталях машин образуется слой из солей натрия и калия, разъедающих сталь и любой другой металл.
- Электрохимическая происходит при соприкосновении с водой. Встречается чаще других видов.
- Биологическая (биокоррозия) заключается в том, что поверхность металла разрушают микроорганизмы или радиоактивное излучение.
В соответствии с формой поражения коррозия может быть точечной, когда появляются узкие глубокие отверстия внутри металла с сохранением целостности поверхности. Она чаще наблюдается в изделиях из алюминиевых сплавов и нержавеющей стали.
Второй тип – равномерная коррозия, проявляющаяся на поверхности металла в виде равномерного слоя отложений. Третий – щелевая, захватывает участки с небольшими углублениями, где накапливается влага. Четвертый – межкристаллическая, развивается в зернистой структуре металла, приводя к локальным повреждениям. Выделяют также коррозионное растрескивание, когда под действием агрессивной среды в сочетании с постоянной или периодической высокой нагрузкой в металле появляются трещины.
Способы борьбы с коррозией
Сегодня применяются различные способы защиты металлов от коррозии. Выбор определяется условиями эксплуатации металлических изделий, в том числе климатом региона, характеристиками самой металлической конструкции, а также совместимостью антикоррозийного состава и обрабатываемого материала, другими факторами.
Все виды борьбы с коррозией металла можно разделить на три основных, направленных на изменение одного из факторов:
- свойств самого металла;
- свойств окружающей среды;
- характера взаимодействия металлического изделия и среды на границе контакта.
Изменение свойств металла для предотвращения коррозии
В эту группу методов включаются легирование, поверхностная и термическая обработка. Первые два можно отнести к химическим методам. Третий – к технологическим методам.
Легирование предполагает включение в состав металла в процессе его производства химических элементов, которые наименее склонны вступать в химическую реакцию с кислородом. Эти компоненты по возрастанию химической эффективности располагаются в следующем порядке: хром, медь, цинк, серебро, алюминий, платина.
Другой способ – металлизация (гальванический метод), когда поверхность изделия покрывается более устойчивым к действию кислорода металлом. Он подается в мелкодисперсном виде в форме ионизированного потока. Сюда относятся холодное цинкование и горячее цинкование.
Для защиты от коррозии могут также применяться фосфатирование или оксалатирование – обработка поверхности металла фосфатными солями марганца и цинка, либо щавелевой кислоты.
Термическая обработка означает нагрев металла до температуры выше +900◦С. Как правило, применяется в сочетании с насыщением поверхности заготовки хромом, азотом, алюминием, кремнием и другими элементами, повышающими сопротивляемость металла коррозии.
Перечисленные выше методы защиты относят к активным. Сюда же можно причислить и преобразование структуры двойного электрического слоя — анодирование. На металлическую поверхность воздействуют постоянным электрическим полем с заданными параметрами напряжения, которые подбираются в соответствии со свойствами металла. Это увеличивает его электродный потенциал и повышает устойчивость к коррозии верхнего слоя. Такой способ обычно используют для создания антикоррозийной защиты алюминия.
Изменение свойств окружающей среды
Параметры окружающей металлическое изделие среды можно менять с помощью ее ингибирования, обескислороживания, осушения воздушной смеси и устранения агрессивных веществ – солей, кислот и других.
Если объект небольшой, вокруг него может создаваться вакуум: в воздухе практически не остается кислорода, соответственно, риск появления коррозии минимизируется.
Другой метод – заполнение пространства вокруг металлической детали или конструкции инертным газом (неоном, ксеноном, аргоном). Этот способ дает высокий эффект, но довольно сложен в применении: необходимо обустройство защитной камеры, а также наличие специальных защитных костюмов для людей, обслуживающих оборудование из металла. Его используют обычно в научно-исследовательских лабораториях и на опытных производственных участках, где требуется поддерживать особый микроклимат.
Изменение характера взаимодействия металла со средой
Это антикоррозийная обработка металла, для которой применяется большое разнообразие способов.
- Защитные покрытия – лаков и красок, масел, смазок и так далее.
- Устранение катодной поляризации в форме защиты от коррозии контактного типа, электродренажа, удаления блуждающих токов и так далее.
- Грамотное проектирование металлических конструкций, при котором подбирается наиболее устойчивый к действию факторов конкретной среды металл, устраняются зазоры, застойные зоны, соприкосновения разнородных металлов, и так далее.
Для борьбы с коррозией металлов широко распространены лакокрасочные покрытия. На сегодняшний день этот вариант применяется особенно часто. Используются специальные органические ЛКМ, компоненты которых не вступают в реакцию с кислородом, в также составы с алюминием. Первые перекрывают доступ О₂.
Вторые не допускают коррозионного разрушения стали за счет наличия в составе химически инертного элемента – алюминия. Кроме того, используют защитные пленки и жидкий пластик – относительно новое решение.
На эффективность такой защиты влияют качество подготовки металлической поверхности к нанесению покрытия, равномерность его нанесения, толщина и прочность слоя, исключение образования воздушных полостей и другие факторы.
Этот способ отличается простотой реализации и низкими финансовыми затратами. Однако эффект недолговечен: со временем происходит механическое разрушение покрытия. Важно также понимать, что ЛКМ и пленки препятствуют появлению коррозии, но не способны его предотвратить, что дает основания называть данный способом защиты от коррозии пассивным. Можно покрыть ржавый металл специальной краской, которая трансформирует ржавчину и создаст антикоррозийный защитный слой.
К необычным способам относится высоковязкая технологическая смазка из окислов железа – закиси-окиси Fe3O4. Температура образования данного вещества составляет +250-500◦С. Им можно обработать металл, чтобы не ржавел. Образуя на поверхности плотную пленку, Fe3O4 не дает кислороду проникать к металлу, не позволяя развиваться трибохимической коррозии. Данный метод применяется на металлургических предприятиях в процессе скоростной высадки сплавов и металлов труднодеформируемых типов.
Способы удаления коррозии
Если ржавчина на металле уже появилась, риск разрушения деталей или конструкций резко возрастает. Необходимо удалить коррозию, для чего предлагается использовать один из способов.
- Ручная механическая очистка – традиционный вариант. Поверхность изделия обрабатывается металлической щеткой, наждачной бумагой либо абразивным кругом. Можно делать это вручную или с помощью дрели с соответствующей насадкой, либо углошлифовальной машины. Метод требует больших усилий и много времени.
- Специальные химические составы, вступающие в реакцию с оксидом железа. Данный вариант актуален для изделий, форма которых сложная, поверхность рифленая. Однако применять этот метод на изделиях с неметаллическими компонентами нельзя. Кроме того, работа с такими средствами требует особой осторожности, поскольку они могут нанести вред здоровью человека.
- Электрохимический способ. Металлическое изделие опускают в раствор электролита, подключив к источнику электротоку. Ток, проходящий через электролит и деталь, заставляет слой ржавчины отделяться от ее поверхности. Но этот вариант подходит не для всех изделий из металла.
- Пескоструйная и дробеструйная обработка, ультразвук очищают металл от оксида железа, отбивая его от поверхности.
- Сухой лед (криобластинг) – очищение с помощью струи из гранул сухого льда. При ударе о металл происходит испарение частичек льда. Высвобождается углекислый газ: мгновенно расширяясь, он захватывает и удаляет ржавчину.
Вложения в защиту металла от коррозии позволяют продлить срок службы деталей и конструкций, а, значит, увеличить периодичность их замены.
Максимальный эффект дает сочетание нескольких методов. Например, для сохранения металлических элементов, находящихся под водой, применяют комбинацию катодной защиты и ЛКМ. Антикоррозийная защита направляющих насадок гребных винтов включает применение коррозионностойкой стали, электроразъединение разнородных материалов, катодную защиту и ЛКМ.
Источник: umecon.ru
Ржавчина

Ржа́вчина является общим термином для определения оксидов железа. В разговорной речи этот термин применяется к красным окислам, образующимся в результате реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в результате реакции железа с хлором при отсутствии кислорода.
Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы визуально или с помощью спектроскопии, они формируются при разных внешних условиях. [1] Ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и метагидроксида железа (FeO(OH), Fe(OH)3). При наличии кислорода и воды и достаточном времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. Поверхность ржавчины не создаёт защиту для нижележащего железа, в отличие от образования патины на медной поверхности.
Ржавчиной как правило называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно оксиды обычно не называют ржавчиной.
Химические реакции


Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.
Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, чугун), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций.
Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления.
Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух агентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы. [2]
Происходящие реакции


Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформации поверхности, вызванная сильным окислением.
Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду. [3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановления кислорода:
Поскольку при этом образуются ионы гидроксидов, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
4 Fe 2+ + O2 → 4 Fe 3+ + 2 O 2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
Fe 2+ + 2 H2O ⇌ Fe(OH)2 + 2 H + Fe 3+ + 3 H2O ⇌ Fe(OH)3 + 3 H +
что приводит к следующим реакциям поддержания баланса дегидратации:
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Кроме того, эти сложные процессы зависят от присутствия других ионов, таких как Ca 2+ , которые служат в качестве электролита, и таким образом, ускоряют образование ржавчины, или в сочетании с гидроксидами и оксидами железа образуют различные осадки вида Ca-Fe-O-OH.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняет цвет ржавчины с жёлтого на синий.
Предотвращение ржавления


Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали формируется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя.
В более агрессивных средах (таких, как солёная вода), предпочтительнее является кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия.
В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. История красок для нанесения на ржавчину насчитывает 50 лет, когда в Англии была изобретена краска Hammerite. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска.
Такие средства обработки содержат также ингибиторы от коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла

Ржавчина может полностью разрушить железо. Обратите внимание на гальванизацию незаржавевших участков.
- Оцинковка (оцинкованное железо/сталь): железо или сталь покрываются слоем цинка. Может использоваться метод горячего цинкования или метод цинкового дутья. : мягкая листовая сталь покрывается слоем олова. : тонкий слой хрома наносится электролитическим способом на сталь, обеспечивая как защиту от коррозии, так и яркий, полированный внешний вид. Часто используется в блестящих компонентах велосипедов, мотоциклов и автомобилей.
Воронение
Воронение — это метод, который может обеспечить ограниченную устойчивость к коррозии для мелких предметов из стали, таких как огнестрельное оружие и др. Метод состоит в получении на поверхности углеродистой или низколегированной стали или чугуна слоя окислов железа толщиной 1-10 мкм. Для придания блеска, а также для улучшения защитных свойств окисной плёнки, её пропитывают минеральным или растительным маслом.
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающей железо атмосферы. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах.
Экономический эффект


Ржавчина вызывает деградацию инструментов и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое «поеданием ржавчиной».
Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главным фактором разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.


Мост Кинзу в штате Пенсильвания была снесён торнадо в 2003 году в значительной степени потому, что центральные базовые болты, соединяющие конструкцию с землёй, проржавели, предоставив мосту возможность держаться просто под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские проблемы. Это один из наиболее распространённых отказов железобетонных мостов.
Источник: dic.academic.ru
